Additive Fertigung hybrider Hüftimplantate
Unter Verwendung der additiven Fertigungstechnologie lassen sich Implantate in biomechanisch angepasster, hybrider Leichtbauweise mit einer dem natürlichen Knochen angenäherten Steifigkeit herstellen. Der Einsatz eines Homogenisierungsansatzes für die optimierten Implantatbereiche mit Gitterstrukturen erlaubt durch eine deutliche Verkürzung der Simulationszeiten eine Integration einer verzugskompensierenden und temperaturstabilisierenden Prozesssimulation der additiven Fertigung in eine individualisierte Serienproduktion.

Bild 3. Erprobung unterschiedlicher Druckausrichtungen und Stützstrukturen.
Foto: EOS GmbH
Ausgabe 5-2022, S. 292–296
HybridHipProcess – Manufacturing of customizable stiffness-optimized hip stems – Additive Manufacturing of Hybrid Hip Implants
Abstract: Implants with a biomechanically customized hybrid lightweight design that is adapted to the stiffness of the native bone can be produced using additive manufacturing technology. The use of a homogenization approach for the optimized implant areas with lattice structures enables the integration of a process simulation of the additive manufacturing process including a distortion compensation and temperature stabilization into a customized serial production by a considerable reduction of the simulation time.
1 Einleitung
Mit über 240 000 Operationen pro Jahr ist der Ersatz des Hüftgelenks der am häufigsten durchgeführte Eingriff in der endoprothetischen Chirurgie in Deutschland und damit unter sozioökonomischen Gesichtspunkten von großer gesellschaftlicher Bedeutung [1].
Implantate mit optimalen mechanischen Eigenschaften und bestmöglicher Passform, die gleichzeitig eine optimale Rekonstruktion der dreidimensionalen individuellen Patientenanatomie ermöglichen, sind ein Schlüssel für eine hohe Lebensdauer der Endoprothese und somit für eine hohe Lebensqualität im Alter [2, 3]. In diesem Zusammenhang stellt das endoprothetisch versorgte Hüftgelenk eine besondere Herausforderung dar und dient im Rahmen dieses Projektes als Anwendungsfokus bei der Entwicklung eines Design- und Fertigungskonzepts für die additive Fertigung derartiger Produkte.
Trotz Fortschritten in der Implantatentwicklung weichen gegenwärtige Prothesenschäfte aus materialtechnischer und biomechanischer Sicht erheblich vom nativen Oberschenkelknochen ab. Als Werkstoffe werden in der Hüftendoprothetik derzeit fast ausschließlich Titan- (Ti6Al4V) oder Cobalt-Chrom-Molybdänlegierungen (CoCrMo) verwendet, deren Elastizitätsmodul (E-Modul) bei circa 110 GPa (Ti6Al4V) beziehungsweise circa 230 GPa (CoCrMo) liegt und damit um den Faktor 7 bis 14 größer als das E-Modul des Knochens (circa 16 GPa) ist. Prothesenschaft und umgebender Knochen weisen Unterschiede in der Steifigkeit auf, die unter anderem vom E-Modul abhängig sind. Infolgedessen kommt es zu einer unphysiologischen mechanischen Belastung des Knochens. Daraus kann eine knöcherne Abbaureaktion am Knochen-Implantat Interface mit entsprechender Knochendichteminderung resultieren, die das Auftreten einer Lockerung des Prothesenschaftes oder einer periprothetischen Fraktur begünstigen kann [4, 5]. Als einzig kurativer Ansatz verbleibt in einer derartigen Situation eine aufwendige Wechseloperation mit gravierenden Risiken für den Patienten und hohen sozioökonomischen Folgekosten. Das deutsche Gesundheitssystem wird dadurch jährlich mit circa 400 Millionen Euro nur an Krankenhausfallpauschalen belastet, indirekte und intangible Kosten nicht mit einberechnet [6].
Neben der anzustrebenden angepassten Implantatsteifigkeit ist die exakte Rekonstruktion der Gelenkbiomechanik entscheidend für das postoperative Ergebnis. Gelingt die biomechanische Rekonstruktion nicht oder nur unzureichend, resultieren daraus postoperative Gangasymmetrien mit konsekutivem Rücken- und/oder Knieschmerz, erhöhtem Gleitflächenabrieb und eingeschränktem Bewegungsumfang des Kunstgelenks. Diese Asymmetrien können wieder zu frühzeitigem Implantatverschleiß und Wechseloperationen führen [2, 3, 7].
Als Lösungsansatz erlaubt die additive Fertigungstechnologie eine Implantatherstellung in physiologisch angepasster, hybrider Leichtbauweise mit einer dem natürlichen Knochen angenäherten Steifigkeit in Kombination mit den Vorteilen einer individualisierbaren Geometrie des Schaftes.
2.1. Stand der Technik
Die Steifigkeitsanpassung des Schaftes an den umgebenden Knochen wurde vor allem simulativ vielfach mittels der Finiten Elemente Methode (FEM) untersucht [8–14]. Nur wenige der simulativ erprobten Ansätze wurden bisher mittels additiver Fertigung hergestellt und experimentell am Prüfstand getestet [15–17].
Mittels Elektronenstrahlschmelzen (engl. Electron Beam Melting, EBM) hergestellte Kurzschäfte stellen das einzige bekannte am Markt befindliche System gedruckter Schäfte dar für das klinischen Zwischenergebnisse vorliegen [18]. Allerdings wurde in diesem Fall keine Steifigkeitsanpassung des Schaftes im Bereich der intertrochantären Verankerung durchgeführt. Da beim EBM Druckverfahren die Entfernung des unverdruckten Werkstoffs eine gute Zugänglichkeit erfordert, erscheint es für einen hybriden Schaftaufbau mit innenliegenden Hohlräumen weniger geeignet als das selektive Laserschmelzen (engl. Selective Laser Melting, SLM). Bei diesem verbleibt der unverdruckte Werkstoff in loser Pulverform. Des Weiteren resultiert aus der limitierten Auflösung des EBM Verfahrens eine unter Umständen zu grobe Oberflächenbeschaffenheit [19].
Ziel des Projektes ist somit die Entwicklung eines standardisierten softwaregestützten teilautomatisierten Prozesses für das Design steifigkeitsoptimierter Hüftschäfte mit der Möglichkeit der individualisierbaren biomechanischen Geometrieadaption und deren wirtschaftlichen Herstellung mittels additiver SLM Fertigungstechnologie.
2 Methode
2.2 HybridHip Prozess
Der HybridHip Prozess ist in Bild 1 dargestellt.
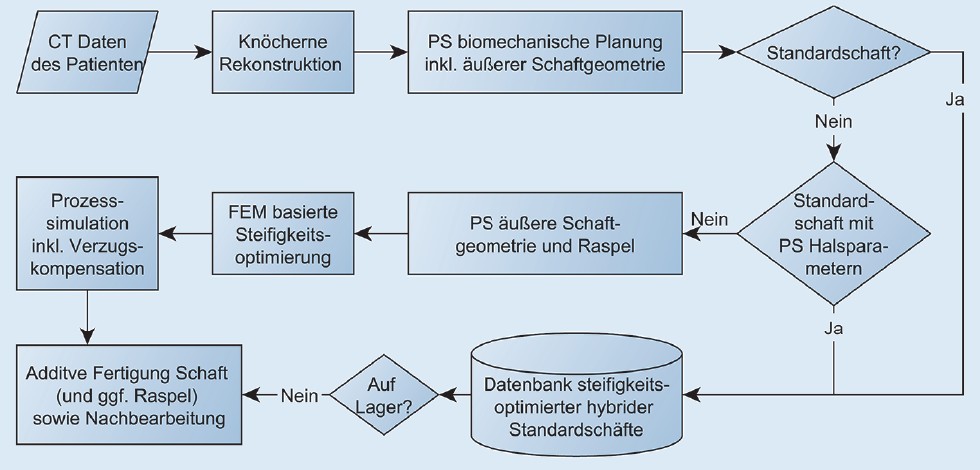
Bild 1. HybridHip Prozess. CT = Computertomographie, PS = patientenspezifisch, FEM = Finite Elemente Methode. Grafik: AQ Solutions GmbH
Die vier wichtigsten Prozessschritte gliedern sich in präoperative Planung, Steifigkeitsoptimierung, Prozesssimulation und additive Fertigung. Da bei Standardschäften die äußere Geometrie festgelegt ist und nicht individuell verändert wird, kann die Steifigkeitsoptimierung und Prozesssimulation inklusive Verzugskompensation im Voraus durchgeführt werden und die Ergebnisse werden in einer Datenbank hinterlegt. Beim patientenspezifischen Schaft müssen diese Prozessschritte für jedes Implantat vor der Fertigung durchgeführt werden. Dann wird der Schaft mittels des additiven SLM-Verfahrens hergestellt und anschließend nachbearbeitet. Für den patientenspezifischen Schaft muss zusätzlich eine entsprechende Raspel zur Präparation des Knochenlagers gefertigt werden.
2.2.1 Präoperative Planung
Nach der Rekonstruktion der Knochengeometrie des Patienten im Bereich des Hüftgelenks anhand von CT-Daten wird die patientenspezifische funktionelle 3D-Planung des Schaftes unter Berücksichtigung anatomisch und biomechanischer Zielparameter durchgeführt. Zu diesen Parametern zählen unter anderem der femorale Offset, der CCD-Winkel, die Anteversion des Oberschenkelhalses und die Beinlängendifferenz. In Abhängigkeit der Beschaffenheit des kontralateralen Hüftgelenks kann dieses als Referenz für die Planung herangezogen werden. Bei bestehenden Pathologien oder Deformationen der kontralateralen Seite muss gegebenenfalls auf anthropometrische Daten zurückgegriffen werden. Falls eine Standardschaftgeometrie die Erfüllung der geplanten Zielparameter nicht gewährleisten kann, wird ein patientenspezifischer Schaft geplant. Gegebenenfalls ist hier eine patientenspezifische Anpassung der Halsparameter, wie Offset, CCD-Winkel oder Anteversion ausreichend, wobei der distale Anteil einer Standardschaftgeometrie folgt. Ist dies nicht der Fall, wird ein vollständig patientenspezifischer Schaft geplant, für den auch die entsprechende Raspel hergestellt werden muss.
2.2.2 Steifigkeitsoptimierung
Sowohl für den patientenspezifischen Schaft als auch für die Standardschäfte wird unter strenger Beibehaltung der äußeren Geometrie eine FEM-basierte Steifigkeitsoptimierung durchgeführt, die auch zu einer Reduzierung des eingesetzten Werkstoffvolumens führt. Die äußere Geometrie des Schaftes darf nicht verändert werden, da die Passform des späteren Implantates im Patienten zwingend eingehalten werden muss. Die äußere Oberfläche des Schaftes muss geschlossen bleiben, darf also nicht als offene Struktur gestaltet werden, um eine übermäßige Osseointegration im Falle einer Revision zu verhindern. Des Weiteren können von außen zugängliche Toträume im Inneren des Schaftes ein potenzielles Infektionsrisiko darstellen. Die Biegesteifigkeit des Schaftes wird im intertrochantären Bereich des Knochenkontaktes der Biegesteifigkeit des Knochens angenähert. Ausgehend von einem einfachen Hohlraum, der gegebenenfalls durch Gitterstrukturen gefüllt wird, wurden hier im Rahmen des Projektes verschiedene Designansätze untersucht. Die Basis der Optimierung sind initial definierte Worst-Case Geometrien für die experimentell eine ausreichende Dauerfestigkeit ermittelt wurde. Unter Berücksichtigung eines Sicherheitsfaktors dürfen die simulierten Spannungswerte dieser Worst-Case Geometrien während der Steifigkeitsoptimierung nicht überschritten werden.
2.2.3 Prozesssimulation
Nach abschließender Definition der steifigkeitsoptimierten Bauteilgeometrie wird eine Simulation des additiven Herstellungsprozesses durchgeführt, um sowohl Passform als auch Eigenschaft des Schafts sicherzustellen. Im Rahmen des „HybridHip“ Prozesses werden dabei mithilfe eines Homogenisierungsansatzes die makroskopischen Eigenschaften und das Prozessverhalten des Bereichs mit Gitterstruktur approximiert und in eine schnelle Prozesssimulation integriert. So ist die Anwendbarkeit des Ansatzes auch für eine individualisierte Serienproduktion gewährleistet, in der die Rechenzeit der Prozesssimulation einen kritischen Faktor darstellt.
Bild 2 zeigt den Workflow zur schnellen Simulation von Bauteilen mit Gitterstruktur unter Verwendung der Software „Amphyon“ oder „3DXpert“ (Oqton, 3D Systems GmbH).
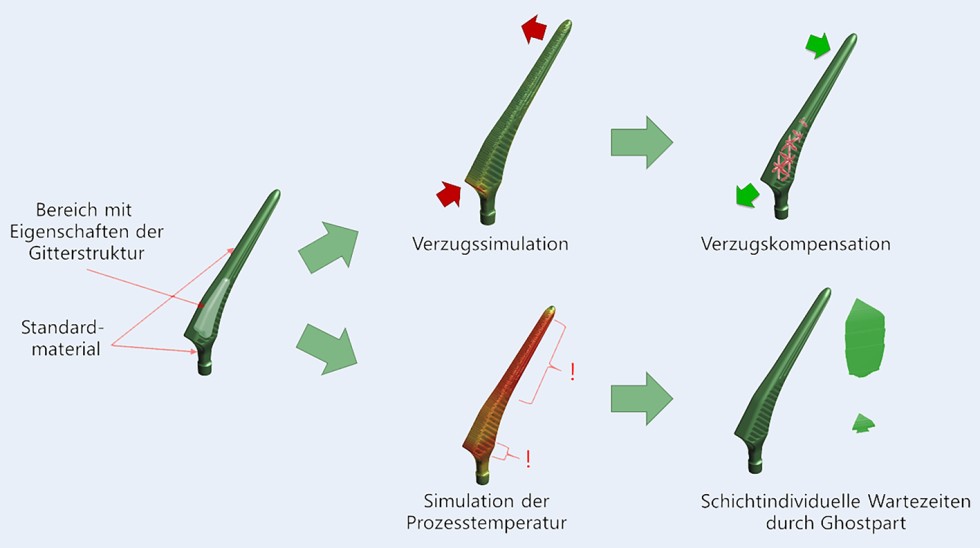
Bild 2. Workflow der Prozesssimulation im HybridHip Prozess. Oben: Verzugskompensation durch Anpassung des Ausgangsmodells. Unten: Adaption der Schichtzeiten zur thermischen Stabilisierung durch Integration einer zusätzlichen Geometrie (Ghostpart), die mit einem 0-Watt Parameter versehen wird. Grafik: Oqton, 3D Systems GmbH
Zu Beginn werden die unterschiedlichen Bereiche des Bauteils mit effektiven Eigenschaften versehen, um anschließend sowohl die mechanische als auch die thermische Prozesssimulation zur Identifikation von Verzug und Überhitzungen durchzuführen. Daraus resultierend kann eine kompensierte Geometrie inklusive Gitterstruktur generiert werden, die die Maßhaltigkeit unter Berücksichtigung des Prozessverzugs sicherstellt. Zusätzlich können bei Bedarf Maßnahmen zur thermischen Stabilisierung des Prozesses, wie beispielsweise eine lokale Anpassung der Schichtzeiten, abgeleitet werden.
Bei der Simulation ist zu beachten, dass die Ergebnisse stark von der gewählten Ausrichtung des Bauteils während des Druckprozesses abhängen. Für die Simulation wurde die Ausrichtung des Bauteils identisch zur Ausrichtung des realen Druckprozesses, wie in Bild 3 rechts dargestellt, übernommen.
2.2.4 Additive Fertigung
Für die additive Fertigung mittels SLM-Verfahren wird der bewährte Implantatwerkstoff Ti6Al4V verwendet. Die Vorteile des SLM-Verfahrens gegenüber dem EBM-Verfahren wurden in Abschnitt 2.1 bereits erläutert. Im Rahmen des Projekts wurden innovative Lösungsansätze erprobt, um die Verwendung von Stützstrukturen, die nach dem Druck spanend entfernt werden müssen, zu minimieren (Bild 3). Um die Materialeigenschaften von geschmiedetem Ti6Al4V nach ISO 5832–3 zu erreichen, folgt auf den Druckprozess eine Wärmebehandlung durch heißisostatisches Pressen (HIP). Durch den für Titanlegierungen optimierten HIP-Prozess können die anisotropen Werkstoffeigenschaften der additiv gefertigten Bauteile reduziert werden [20]. Nachfolgend wird der hochbeanspruchte Hals- und Schulterbereich des Schaftes spanend nachbearbeitet und poliert. Um eine vollständige spanende Nachbearbeitung im Hinblick auf eine wirtschaftliche Fertigung zu vermeiden, wurden verschiedene Verfahren zur Oberflächenbehandlung des distalen Schaftbereichs evaluiert.
2.2.5 Forschungsschwerpunkte
Aus den vier zuvor erläuterten Prozessschritten ergaben sich die Forschungsschwerpunkte des vom Bundesministerium für Bildung und Forschung geförderten Projektes HybridHipProcess, die es initial zu untersuchen galt. Dazu zählte unter anderem die Aufgabe den Nachbearbeitungsaufwand nach der additiven Fertigung unter Einhaltung der geforderten Dauerfestigkeitskennwerte zu minimieren. Im Rahmen der Prozesssimulation stellte sich die Frage nach einer ausreichenden Reduktion der Simulationsdauer durch eine Homogenisierung der Gitterstruktur ohne wesentliche Änderung der Simulationsergebnisse. Auf diese Frage soll nachfolgend genauer eingegangen werden.
3 Ergebnisse
In Bild 4 ist der Vergleich der konventionellen Prozesssimulation, in der die komplette Gitterstruktur detailliert abgebildet wurde, mit der homogenisierten Prozesssimulation dargestellt.
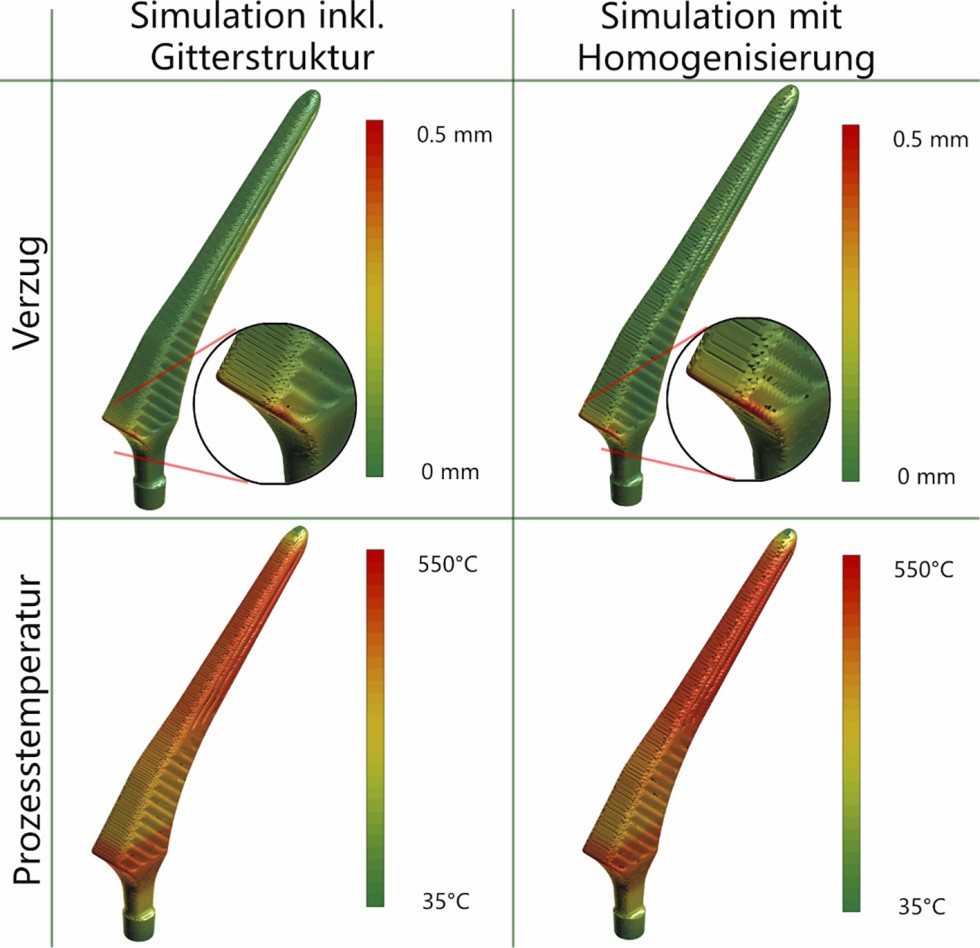
Bild 4. Vergleich der Simulationsergebnisse mit und ohne Homogenisierung. Grafik: Oqton, 3D Systems GmbH
In der Simulation mit detaillierter Gitterstruktur wird ein maximaler Verzug von 0,43 mm normal zur Oberfläche des Implantats vorhergesagt. In der Simulation mit homogenisiertem Bereich liegt der maximale Verzug bei 0,45 mm. Die maximale Differenz zwischen beiden Simulationen beläuft sich somit auf 0,02 mm. Die Rechenzeit für die Verzugssimulation verkürzte sich von 31 auf 5 Minuten.
Bei der thermischen Simulation liegen die berechneten Prozesstemperaturen bei 548 °C beziehungsweise 535 °C. Die maximale Differenz zwischen beiden Simulationen beläuft sich auf 13 °C. Die Rechenzeit der thermischen Simulation reduzierte sich von vier Minuten auf eine Minute.
Die vollständige Simulationsdauer wurde somit um 83 % gesenkt.
4 Diskussion, Fazit und Ausblick
Die Gesamtdauer der Prozesssimulation konnte um 83 % auf 6 Minuten reduziert werden und lässt sich damit deutlich besser in eine individualisierte Serienproduktion integrieren. Die maximale Differenz der Verzugssimulation mit und ohne Homogenisierung von 0,02 mm liegt für den Schaftbereich mindestens um den Faktor 10 niedriger als die geforderten Toleranzen für Längenmaße nach ISO 27681 (Klasse m) und wird deshalb als akzeptabel eingestuft.
Die Differenz der maximal in der Simulation erreichten Temperaturen liegt bei 13 °C und skaliert annähernd linear mit der simulierten Maximaltemperatur. Diese Temperaturen werden jeweils im Bereich oberhalb der Gitterstruktur erreicht. Dabei ist zu beachten, dass in der durchgeführten Simulation ein einzelnes Bauteil auf der Basisplatte und ohne Wartezeiten simuliert wurde. Bei gleichzeitigem Druck mehrerer Bauteile und den damit verbundenen Wartezeiten ist die zu erwartende Temperatur entsprechend niedriger, was den Fehler ebenfalls niedriger ausfallen lässt.
Der beschriebene Homogenisierungsansatz in Rahmen der Prozesssimulation lässt sich auf weitere Anwendungsgebiete übertragen. Ein vielversprechender Anwendungsfall im Bereich der Revisionsendoprothetik stellt der individuell gewichtsoptimierte Beckenteilersatz als Gelenkpartner zum Hüftschaft dar. Aufgrund größerer Bauteilquerschnitte erhöht sich hierbei das Verzugsrisiko, das durch den Einsatz der Prozesssimulation kontrolliert werden kann. Grundsätzlich lässt sich festhalten, dass die Simulation additiv gefertigter Gitterstrukturen mittels Homogenisierung allgemein anwendbar und vor allem dann sinnvoll ist, sobald die Größenordnung der Gitterstruktur im Vergleich zum umgebenden Bauteil ausreichend klein ist. Beispielsweise darf die genaue Position einer einzelnen Strebe in einem Gitter keinen relevanten Einfluss mehr auf das thermische oder mechanische Verhalten des Gesamtbauteils haben, und ein räumlich versetztes Gitter muss zu den gleichen Ergebnissen führen. Unter diesen Voraussetzungen sind Simulationen auf Basis gemittelter Eigenschaften in Bereichen von Gitterstrukturen in den meisten Anwendungen ausreichend genau, wie für das vorliegende Bauteil gezeigt wurde.
In anschließenden Arbeiten soll die Genauigkeit der Verzugskompensation und Stabilisierung der Prozesstemperatur im Rahmen des HybridHip Prozesses evaluiert werden.
Dieses Forschungs- und Entwicklungsprojekt wird mit Mitteln des Bundesministeriums für Bildung und Forschung (BMBF) im Programm „Zukunft der Wertschöpfung – Forschung zu Produktion, Dienstleistung und Arbeit“ (Förderkennzeichen 02P18C000 bis 02P18C003) gefördert und vom Projektträger Karlsruhe (PTKA) betreut. Die Verantwortung für den Inhalt dieser Veröffentlichung liegt bei den Autoren.
Literatur
- Destatis: Fallpauschalenbezogene Krankenhausstatistik (DRG-Statistik) 2019. Operationen und Prozeduren der vollstationären Patientinnen und Patienten der Krankenhäuser (4-Steller), Wiesbaden, 2020
- Innmann, M. M.; Maier, M. W.; Streit, M. R. et al.: Additive Influence of Hip Offset and Leg Length Reconstruction on Postoperative Improvement in Clinical Outcome After Total Hip Arthroplasty. The Journal of arthroplasty 33 (2018) 1, pp. 156–161
- Renkawitz, T.; Weber, T.; Dullien, S. et al.: Leg length and offset differences above 5mm after total hip arthroplasty are associated with altered gait kinematics. Gait & posture 49 (2016), pp. 196–201
- Innmann, M. M.; Streit, M. R.; Bruckner, T. et al.: Comparable Cumulative Incidence of Late Periprosthetic Femoral Fracture and Aseptic Stem Loosening in Uncemented Total Hip Arthroplasty-A Concise Follow-Up Report at a Minimum of 20 Years. The Journal of arthroplasty 33 (2018) 4, pp. 1144–1148
- Peitgen, D. S.; Innmann, M. M.; Merle, C. et al.: Periprosthetic Bone Mineral Density Around Uncemented Titanium Stems in the Second and Third Decade After Total Hip Arthroplasty: A DXA Study After 12, 17 and 21 Years. Calcified tissue international 103 (2018) 4, pp. 372–379
- Bleß, H.-H.; Kip, M. (Hrsg.): White Paper on Joint Replacement: Status of Hip and Knee Arthroplasty Care in Germany. Berlin (Germany) 2018
- Little, N. J.; Busch, C. A.; Gallagher, J. A. et al.: Acetabular polyethylene wear and acetabular inclination and femoral offset. Clinical orthopaedics and related research 467 (2009) 11, pp. 2895–2900
- Wang, Y.; Arabnejad, S.; Tanzer, M. et al.: Hip Implant Design With Three-Dimensional Porous Architecture of Optimized Graded Density. Journal of Mechanical Design 140 (2018) 11
- Sun, C.; Wang, L.; Kang, J. et al.: Biomechanical Optimization of Elastic Modulus Distribution in Porous Femoral Stem for Artificial Hip Joints. Journal of Bionic Engineering 15 (2018) 4, S. 693–702
- Lerch, M.; Windhagen, H.; Kurtz, A.-E. et al.: ‚Pre-launch‘ finite element analysis of a short-stem total hip arthroplasty system consisting of two implant types. Clinical biomechanics (Bristol, Avon) 61 (2019), pp. 31–37
- Alkhatib, S. E.; Tarlochan, F.; Mehboob, H. et al.: Finite element study of functionally graded porous femoral stems incorporating body-centered cubic structure. Artificial organs 43 (2019) 7, E152-E164
- Sh Sufiiarov, V.; V Borisov, E.; V Sokolova, V. et al.: Structural analysis of an endoprosthesis designed with graded density lattice structures. International journal for numerical methods in biomedical engineering (2020), e3420
- Kladovasilakis, N.; Tsongas, K.; Tzetzis, D.: Finite Element Analysis of Orthopedic Hip Implant with Functionally Graded Bioinspired Lattice Structures. Biomimetics (Basel, Switzerland) 5 (2020) 3
- Mehboob, H.; Tarlochan, F.; Mehboob, A. et al.: A novel design, analysis and 3D printing of Ti-6Al-4V alloy bio-inspired porous femoral stem. Journal of Materials Science: Materials in Medicine 31 (2020) 9, p. 78
- Arabnejad, S.; Johnston, B.; Tanzer, M. et al.: Fully porous 3D printed titanium femoral stem to reduce stress-shielding following total hip arthroplasty. Journal of orthopaedic research : official publication of the Orthopaedic Research Society 35 (2017) 8, pp. 1774–1783
- Croitoru, A. S. M.; Pacioga, B. A.; Comsa, C. S.: Personalized hip implants manufacturing and testing. Applied Surface Science 417 (2017), S. 256–261
- Delikanli, Y. E.; Kayacan, M. C.: Design, manufacture, and fatigue analysis of lightweight hip implants. Journal of applied biomaterials & functional materials 17 (2019) 2, 2280800019836830
- Schiraldi, M.; Bondi, M.; Renzi Brivio, L.: Femoral neck preservation with a short hip stem produced with powder manufacturing: mid-term results of a consecutive case series. European journal of orthopaedic surgery & traumatology : orthopedie traumatologie 29 (2019) 4, pp. 801–806
- Fousová, M.; Vojtĕch, D.; Doubrava, K. et al.: Influence of Inherent Surface and Internal Defects on Mechanical Properties of Additively Manufactured Ti6Al4V Alloy: Comparison between Selective Laser Melting and Electron Beam Melting. Materials (Basel, Switzerland) 11 (2018) 4
- Kahlin, M.; Ansell, H.; Basu, D. et al.: Improved fatigue strength of additively manufactured Ti6Al4V by surface post processing. International Journal of Fatigue 134 (2020), S. 105497
Dipl.-Ing. Maximilian C. M. Fischer
AQ Solutions GmbH
An der Hasenkaule 10, 50354 Hürth
Tel. +49 2233 / 460 96 60
info@aq-solutions.de
www.aq-solutions.de
John W. Schlasche, M. Sc.
3DSystems GmbH
Fahrenheitstr.1, 28359 Bremen
Tel. +49 421 / 331 001 20
john.schlasche@oqton.com
www.oqton.com
Stefan Schröder, M. Sc.
Prof. Dr. sc. hum. J. Philippe Kretzer
Labor für Biomechanik und Implantatforschung
Orthopädische Universitätsklinik Heidelberg
Schlierbacher Landstr. 200a, 69118 Heidelberg
Tel. +49 6221 / 56 27301
info@implantatforschung.de
www.implantatforschung.de
Priv.-Doz. Dr. med. Moritz M. Innmann
Univ.-Prof. Dr. med. habil. Tobias Renkawitz
Orthopädische Universitätsklinik Heidelberg
Schlierbacher Landstr. 200a, 69118 Heidelberg
Tel. +49 6221 / 56 26302
direktion.orthopaedie@med.uni-heidelberg.de
www.klinikum.uni-heidelberg.de