Mit Mikroben zum grünen Ethylen – ein Enzym öffnet neue Wege für nachhaltige Kunststoffe
Ethylen gilt als einer der wichtigsten Bausteine der Kunststoffindustrie – doch seine Herstellung aus fossilen Rohstoffen verursacht hohe CO2-Emissionen. Forschende des Max-Planck-Instituts für terrestrische Mikrobiologie in Marburg haben nun ein Enzym identifiziert, das Ethylen unter Sauerstoffausschluss produziert, ohne CO2 freizusetzen. Die Erkenntnisse liefern nicht nur die Grundlage für eine biotechnologische, emissionsfreie Ethylenproduktion, sondern auch neue Einsichten in frühe biochemische Prozesse der Erde.
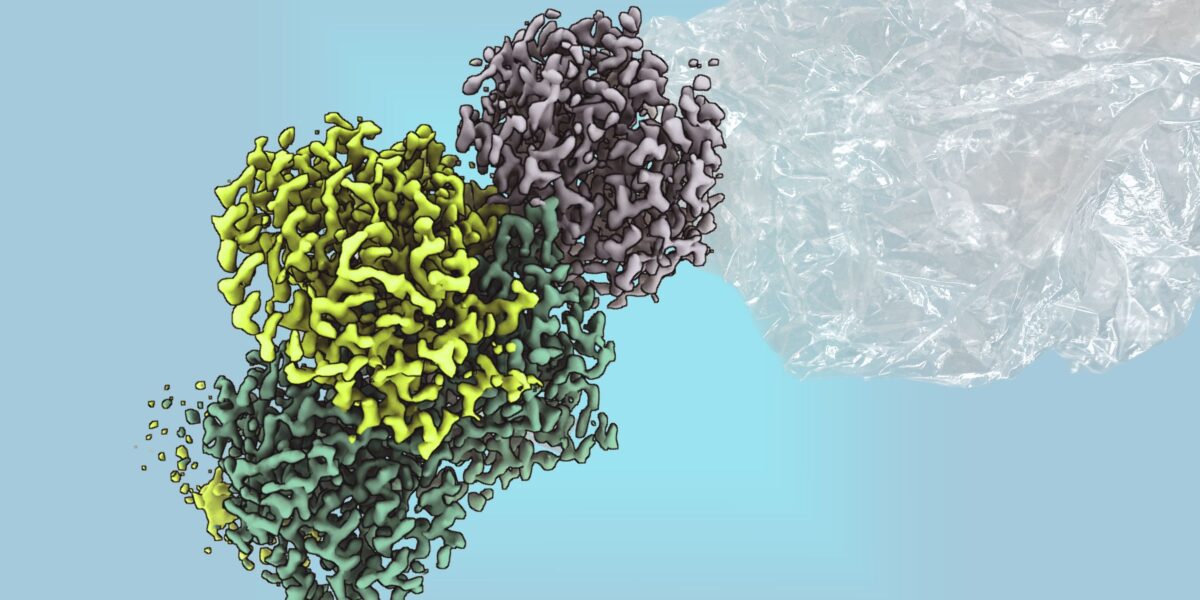
Mit einem bakteriellen Enzym könnte man zukünftig Plastik nachhaltig erzeugen.
Foto: Max-Planck für terrestrische Mikrobiologie/Geisel
Ethylen ist ein zentraler Ausgangsstoff für Kunststoffe und chemische Produkte weltweit. Heute wird er überwiegend aus fossilen Energieträgern hergestellt – ein Prozess, der erhebliche Mengen an Treibhausgasen verursacht. Der steigende Bedarf in der Kunststoffproduktion macht die Entwicklung alternativer, CO2-neutraler Herstellungsverfahren dringlicher denn je.
Forschende sehen in der Biotechnologie eine mögliche Lösung. Bakterien, die bestimmte Stoffwechselwege nutzen, könnten Ethylen auf umweltfreundliche Weise erzeugen. Doch in der Natur sind bislang nur wenige Enzyme bekannt, die diesen Prozess leisten können. Meist benötigen sie energieaufwendige Substrate und setzen dennoch Kohlendioxid frei – bislang also keine echte grüne Alternative.
Aus Abfall wird Zukunft: Bakterien verwandeln Styropor in Grundstoffe für Nylon
Ein Bakterium sorgt für Aufsehen
Ein wissenschaftlicher Durchbruch gelang, als im Bakterium Rhodospirillum rubrum ein bislang unbekanntes Enzym entdeckt wurde: Die Methylthioalkan-Reduktase. Das Enzym ermöglicht es dem Mikroorganismus, unter sauerstofffreien Bedingungen Ethylen zu produzieren – ohne CO2-Ausstoß. Damit rückte ein biologischer Weg zur klimafreundlichen Herstellung des Kunststoff-Bausteins in greifbare Nähe. Doch bis vor Kurzem war über das Enzym wenig bekannt. Seine Struktur und Funktionsweise blieben unklar, vor allem, weil sich das hochsensible Metalloenzym nur schwer aufreinigen ließ.
Ein Blick ins Innere der „Great Clusters of Biology“
Ein Forschungsteam am Max-Planck-Institut für terrestrische Mikrobiologie in Marburg hat das Enzym nun erstmals strukturell charakterisiert. Unter der Leitung von Dr. Johannes Rebelein und in Zusammenarbeit mit der RPTU Kaiserslautern gelang es, die Methylthioalkan-Reduktase aufzureinigen und ihre Funktion zu analysieren. Dabei stießen die Forschenden auf eine unerwartete biochemische Besonderheit. „Die Reaktion wird von großen, komplexen Eisen-Schwefel-Clustern angetrieben, von denen man bisher annahm, dass sie nur in den Nitrogenasen, den ältesten Enzymen der Erde, vorkommen“, erklärt Ana Lago-Maciel, Doktorandin und Erstautorin der Studie. „Das Enzym ist das erste Nicht-Nitrogenase-Enzym, von dem bekannt ist, dass es diese Metallcluster enthält.“
Diese Cluster gelten als molekulare Relikte aus den frühesten Phasen der Erdgeschichte. Nitrogenasen entstanden vor Milliarden von Jahren und sind die einzigen bekannten Enzyme, die Stickstoff aus der Atmosphäre binden und so für biologische Systeme nutzbar machen. Ihre komplexen Eisen-Schwefel-Cluster zählen zu den sogenannten „Great Clusters of Biology“ – außergewöhnliche Metallstrukturen, die für zentrale Lebensprozesse verantwortlich sind.
Textilbeton im Härtetest: BAM erforscht Brandschutz für innovative Baustoffe
Ein Enzym mit erstaunlicher Vielseitigkeit
Die neue Studie zeigt, dass die Methylthioalkan-Reduktase nicht nur Ethylen, sondern auch andere Kohlenwasserstoffe bilden kann. „Tatsächlich hat das Enzym eine bemerkenswerte Vielseitigkeit“, erklärt Dr. Johannes Rebelein, Leiter des Forschungsprojekts. „Es kann eine Reihe von Kohlenwasserstoffen produzieren, neben Ethylen auch Ethan oder Methan.“
Damit eröffnet sich ein breiteres Verständnis, wie Enzyme auf molekularer Ebene chemische Bindungen aufbrechen und neu formen können – ein Mechanismus, der für die Entwicklung biotechnologischer Verfahren zur Herstellung von Treibstoffen und Kunststoffen von zentraler Bedeutung ist.
Neue Perspektiven für nachhaltige Kunststoffproduktion
Die Ergebnisse liefern wichtige Anhaltspunkte für die zukünftige Nutzung solcher Enzyme in industriellen Prozessen. Im Unterschied zu den klassischen Nitrogenasen verfügt das Enzym über ein anderes Substratspektrum, das sich gezielt verändern lässt. „Unsere Arbeit liefert die Grundlage, um diese Enzyme biotechnologisch zu zähmen und ihr Produktspektrum an unsere Bedürfnisse anzupassen“, sagt Johannes Rebelein.
Das Wissen um den Aufbau und die Reaktivität der Metallcluster bietet damit einen molekularen Bauplan für nachhaltige Produktionswege. Das Ziel: Ethylen aus erneuerbaren Quellen herstellen, ohne CO2-Emissionen und ohne fossile Ausgangsstoffe.
Bor-Komplexe mit Olefinen eröffnen Alternativen zu Schwermetallen
Ein Blick in die frühe Biochemie der Erde
Neben dem praktischen Nutzen für die Kunststoffindustrie besitzt die Entdeckung auch eine fundamentale wissenschaftliche Dimension. Die Struktur des Enzyms legt nahe, dass ähnliche Mechanismen bereits vor der Entstehung moderner Nitrogenasen existierten. „Die Ergebnisse deuten darauf hin, dass strukturell ähnliche Enzyme diese Cluster bereits für die reduktive Katalyse nutzten, lange bevor sich die Nitrogenasen selbst entwickelten. Dies ist eine dramatische Wende in unserem Verständnis dieses entscheidenden Teils der Lebensgeschichte auf der Erde“, erklärt Johannes Rebelein.
Damit liefert die Forschung nicht nur eine Grundlage für eine klimafreundlichere Industrie, sondern zugleich neue Erkenntnisse über die Evolution komplexer Enzyme und die frühe Entwicklung des Lebens auf der Erde.