Nobelpreisträger schafft Durchbruch: Dieses Mikroskop stößt in ganz neue Dimensionen vor
Das weiterentwickelte Minflux-Mikroskop von Nobelpreisträger Stefan Hell und seinem Team beobachtet winzige Bewegungen einzelner Proteine noch detaillierter als jemals zuvor. Es hilft dabei, Krankheiten besser zu verstehen und Therapien zu entwickeln.
Das Minflux-Mikroskop von Nobelpreisträger Stefan Hell hilft dabei, Krankheiten besser zu verstehen und Therapien zu entwickeln.
Foto: Panthermedia.net/toeytoey
Das Team von Nobelpreisträger Stefan Hell hat die Minflux-Mikroskopie noch einmal verbessert: Das neue superauflösende Mikroskop besitzt eine räumlich-zeitliche Genauigkeit von einem Nanometer pro Millimeter. Somit lassen sich winzige Bewegungen einzelner Proteine noch detaillierter beobachten als jemals zuvor. Entwickelt wurde es am Max-Planck-Institut für medizinische Forschung in Heidelberg.
Was ist ein Minflux-Mikroskop?
Die Minflux-Mikroskopie wurde von Professor Stefan Hell und seinem Team erfunden. Sie baut auf die STED-Mikroskopie und verwandte Mikroskopieverfahren auf, für die Professor Stefan Hall (und sein Team) 2014 den Chemie-Nobelpreis erhalten hat, gemeinsam mit zwei amerikanischen Kollegen. STED steht hierbei für Stimulated Emission Depletion, kurz gesagt handelt es sich hierbei um eine besondere Form des Lichtmikroskops, dessen Auflösung nicht beugungsbegrenzt ist.
Der Hintergrund: Bis vor einigen Jahren steckte die Mikroskopie in einem Dilemma, denn ein von Ernst Abbe formuliertes Gesetz besagte, dass man mit einem Lichtmikroskop bis maximal etwa 1000-fach vergrößern kann. Das entspricht etwa einer halben Wellenlänge des sichtbaren Lichts, also rund 200 Nanometer. Dieses Gesetz hat Stefan Hell mit seinem Team über den Haufen geworfen. Konnte man mit dem ersten Minflux-Mikroskop bereits wesentlich kleinere Strukturen in lebendigen Zellen und Organismen beobachten, geht das nun mit der Weiterentwicklung noch einmal wesentlich besser.
Was ist neu an der Weiterentwicklung?
Im Jahr 2016 hat Stefan Hell mit seinem Team Minflux erstmals vorgestellt. Bereits damals konnte man fluoreszenzmarkierte Proteine in Zellen verfolgen. Allerdings war die Bewegung der Proteine rein zufällig und die Genauigkeit der Messungen lag in einem Bereich von 10 Nanometern. Auch das war bereits großartig, liegt die von Ernst Abbe formulierte Grenze doch bei 200 Nanometern.
Das nun von der Gruppe vorgestellte Minflux-Mikroskop kann Proteinbewegungen mit einer raumzeitlichen Genauigkeit von bis zu 1,7 Nanometern pro Millisekunde aufzeichnen. Darüber hinaus ist die in Science veröffentlichte Studie die erste, die das bisher unerreichte raumzeitliche Auflösungsvermögen von Minflux auf Konformationsänderungen von Proteinen anwendet. Hier wird insbesondere das Motorprotein Kinesin-1 genannt.
Welche Bedeutung hat das Motorprotein Kinesin-1?
Das Protein Kinesin-1 spielt eine Schlüsselrolle beim Transport von Fracht durch unsere Zellen. Mutationen des Motorproteins sind die Ursache für mehrere Krankheiten. Je besser die Funktionsweise der Proteine erforscht werden können – und das Minflux-Mikroskop ist ein wichtiges Werkzeug dafür – desto besser können die molekularen Mechanismen hinter vielen Krankheiten verstanden werden. Letztlich geht es dabei auch um die Entwicklung geeigneter Therapien.
Auf dem Weg durch unsere Zellen schreitet das Kinesin-1 an Filamenten (den Mikrotubuli) entlang und wechselt dort ständig seine Position. Diese Bewegung erfolgt normalerweise entlang eines der 13 Protofilamente, die die Mikrotubuli bilden. Das Voranschreiten dieser „Köpfe“ wird dabei durch die Spaltung des Hauptenergielieferanten der Zelle ATP (Adenosintriphosphat) angetrieben. Durch das Minflux-Mikrokop werden diese Bewegungen sichtbar.
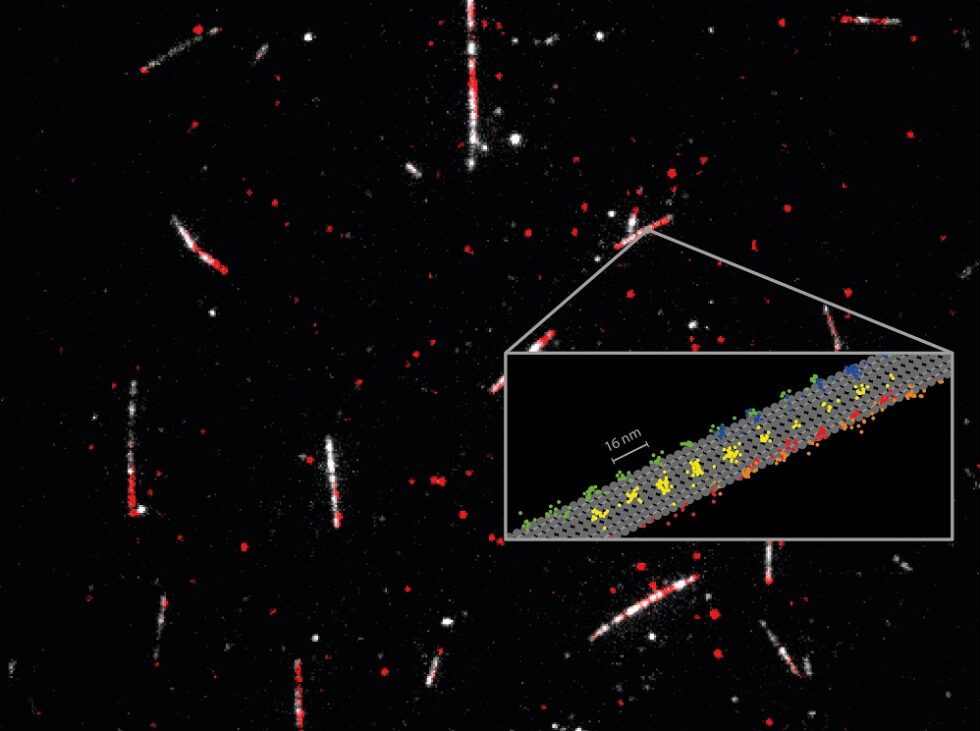
Detaillierte Messung des Motorprotein Kinesin-1 (rot), wie es auf den Mikrotubuli (weiß) entlang „läuft“.
Foto: Otto Wolff, Lukas Scheiderer (Max-Planck-Institut für medizinische Forschung)
Wie werden die Protein-Bewegungen sichtbar?
Mit bisherigen Methoden konnten die Bewegungen der Proteine nur stark eingeschränkt sichtbar gemacht werden. Das lag insbesondere daran, dass die beiden Dimensionen „Auflösung“ und „Zeit“ in den entscheidenden Bereichen nicht gleichzeitig erfasst werden konnten. Einige dieser Methoden sind in der Lage hohe räumliche Auflösungen zu erfassen, können jedoch die Änderungen zeitlich nicht schnell genug verfolgen. Bei anderen Methoden ist es genau umgekehrt, da die Markierung mit lichtstreuenden Kügelchen aus Gold, Germanium oder Latex erfolgt, die um zwei bis drei Größenordnungen größer sind als das zu untersuchende Protein selbst.
Für Minflux hingegen muss nur ein herkömmliches Fluoreszenzmolekül mit einer Größe von ca. einem Nanometer an das Protein gebunden werden. So kann Minflux die hohe Auflösung erreichen, während es die Proteinfunktion so gut wie nicht stört. Das ist für die Untersuchung der Bewegung nativer Proteine unabdingbar. „Ein vom Rauschen aus der Umgebung abgeschirmtes Minflux-Mikroskop, welches nah an der theoretischen Grenze arbeitet, ist die eine Herausforderung“, sagt Otto Wolff, Doktorand in der Gruppe. „Und die Experimente so durchzuführen, dass sie die Proteinfunktion nicht beeinflussen und dennoch den biologischen Mechanismus zeigen können, ist eine zweite“, ergänzt sein Kollege Lukas Scheiderer.
Neues Kapitel in der Erforschung einzelner Proteinmoleküle
Mit dem Minflux-Mikroskop lässt sich nun erstmals die räumlich-zeitliche Bewegung von Proteinen im Bereich von Nanometern pro Millisekunde zu beobachten. Stefan Hell ist vom zukünftigen Potenzial überzeugt: „Ich bin sicher, wir sind dabei ein neues Kapitel aufzuschlagen, und zwar in der Erforschung der Bewegungen und Formveränderungen einzelner Proteinmoleküle“, sagt der Nobelpreisträger. „Die Kombination aus hoher räumlicher und zeitlicher Auflösung, die Minflux bietet, wird es Wissenschaftlern ermöglichen, Biomoleküle so zu untersuchen, wie es zuvor nicht möglich war.“
Seine Kollegin Jessica Matthias ergänzt: „Ich bin gespannt, wohin uns Minflux noch führen wird. Es fügt der Erforschung der Funktionsweise von Proteinen eine weitere Dimension hinzu. Das kann uns helfen, die molekularen Mechanismen hinter vielen Krankheiten zu verstehen und letztendlich zur Entwicklung von Therapien beitragen.“ Matthias ist eine ehemalige Postdoktorandin in Stefan Hells Gruppe. Sie erforscht nun in einer Ausgründung des Max Planck Instituts die Anwendung von Minflux auf eine Vielzahl biologischer Fragestellungen.
Ein Beitrag von:
















