Luftbelastung in verschiedenen alternativen Haltungsformen für Legehennen
Zusammenfassung Mikroorganismen in der Luft von Legehennenhaltungen stellen eine Belastung für die respiratorische Gesundheit der dort Beschäftigten dar. Dabei können die Konzentrationen abhängig von Tieralter oder Haltungssystem stark schwanken. In dieser Arbeit sollen die Unterschiede zwischen einer Boden-, Volieren-, Freiland- und einer Kleingruppenhaltung hinsichtlich der Konzentrationen ausgewählter Mikroorganismengruppen in der Luft gezeigt werden. Über einen Zeitraum von 27 Monaten fanden sich besonders hohe Konzentrationen in Jahreszeiten mit niedriger Luftwechselrate und in Systemen mit integriertem Scharrbereich sowie in Systemen mit Kotgrube. Die Konzentrationen an Staphylokokken zeigen einen den Gesamtbakterien ähnlichen Verlauf, allerdings deuten sich in den prozentualen Anteilen von Staphylokokken an den Gesamtbakterien unterschiedliche Bakterienspektren im Vergleich der Haltungssysteme an.

Quelle: PantherMedia/Alfred Neumaier
1 Einleitung
In der Luft von Nutztierställen finden sich große Mengen biologischer Partikel, wie z. B. Viren, Bakterien, Schimmelpilzsporen oder deren Fragmente, die zusammenfassend auch als Bioaerosole bezeichnet werden. Vor allem inhaliert können diese die Gesundheit negativ beeinflussen. Allein im Jahr 2013 sind bei der Landwirtschaftlichen Unfallversicherung 417 Atemwegserkrankungen als Berufskrankheiten angezeigt worden [1]. Besonders hohe Bioaerosolkonzentrationen finden sich in der Geflügelhaltung. Hier liegt die geschätzte jährliche Inzidenz für arbeitsplatzassoziierte asthmatische Erkrankungen bei 2,4 % [2] und die Prävalenz chronischer Bronchitiden bei 12 bis 25 % [3 bis 5]. Auch auf Geflügel spezialisierte Veterinäre berichteten vermehrt über Atemwegsstörungen [6]. Als auslösende Agenzien gelten neben luftgetragenen Mikroorganismen vor allem deren Stoffwechsel- und Zerfallsprodukte.
Seit 2009 ist die konventionelle Käfighaltung für Legehennen aus Tierschutzgründen in Deutschland verboten, EU-weit seit 2012. Stattdessen etablierten sich verschiedene alternative Haltungsformen, die auch die Ausübung arteigenen Verhaltens der Tiere (z. B. Gelegenheiten zum Scharren, Picken und Sandbaden, aber auch Rückzugsmöglichkeiten, geschützte Eiablagebereiche oder Sitzstangen in verschiedenen Höhen) ermöglichen sollen. Es ist bereits bekannt, dass die Menge an Bioaerosolen in der Stallluft von der Produktions- und Haltungsform abhängig ist [7 bis 10]. Es stellte sich daher die Frage nach den Unterschieden in diesen neu geschaffenen Arbeitsumwelten im Hinblick auf die mikrobiologischen Belastungen für die (respiratorische) Gesundheit der Beschäftigten.
Die vorliegende Arbeit zeigt anhand vier exemplarisch untersuchter alternativer Haltungsformen für Legehennen auf, ob und wie unterschiedlich die Belastungen mit luftgetragenen Mikroorganismen an diesen Arbeitsplätzen ausfallen können.
2 Material und Methoden
Es wurden vier verschiedene Haltungsformen untersucht: A) eine Bodenhaltung mit Kotgrube und mit innen liegendem Scharrraum, B) eine Volierenhaltung mit Kotbändern und mit innen liegendem Scharrraum, C) eine Bodenhaltung mit Kotgrube und mit Kaltscharrraum und Außenauslauf (Freilandhaltung) und D) eine Kleingruppenhaltung mit wöchentlich geleerten Kotbändern. Die Ställe wurden im wöchentlichen Wechsel angefahren, sodass pro Monat nach Möglichkeit mindestens eine Messung in jeder Haltungsform durchgeführt werden konnte. Die Messkampagne wurde im Juni 2007 begonnen und im August 2009 beendet, der entstandene Datensatz umfasst folglich Messergebnisse aus 27 Monaten. Die Sammlung der Mikroorganismen erfolgte in Anlehnung an die Richtlinie VDI 4252 Blatt 3 [11] mit Impingern vom Typ AGI 30, jedoch mit Phosphatpuffer als Sammelmedium, um einer Verschiebung des pH-Werts der Flüssigkeit durch hohe Ammoniakkonzentrationen im Stall vorzubeugen. Pro Messtermin und Probenahmeort wurden 4 x 2 Parallelproben etwa auf der Mitte der Strecke des Kontrollgangs bzw. zentral im Stall gezogen. Nach Beendigung der Probenahme wurden die Impinger abgedeckt und gekühlt (4 °C) ins Labor transportiert, wo anschließend die mikrobiologische Aufarbeitung erfolgte. Die Proben wurden mittels kulturbasierter Verfahren auf die Konzentrationen verschiedener, nach VDI 4250 Blatt 1 und 3 [12; 13] auch gesundheitlich relevanter, Mikroorganismengruppen untersucht. Diese sind zusammen mit den eingesetzten Nährmedien und den Kultivierungsbedingungen in der Tabelle dargestellt.
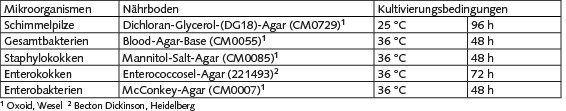
Tabelle: Nährmedien und Kultivierungsbedingungen für die untersuchten Mikroorganismengruppen.
Von den Impingerproben wurden jeweils Verdünnungsreihen angelegt, von diesen Aliquots von 100 μl entnommen und jeweils in drei Ansätzen auf den entsprechenden Nährboden ausgespatelt. Nach Bebrütung der Proben wurden die Kolonie bildenden Einheiten (KBE) ausgezählt und mit der entsprechenden Verdünnungsstufe, dem Probenluftdurchsatz und der Sammelzeit die Konzentration der Mikroorganismen pro m³ Luft berechnet.
Die tabellarische Aufnahme der Daten und ihre statistische Analyse erfolgte mit Excel (Windows XP, Version 7.0, Microsoft Corporation Redmont, Washington, USA) und SAS (SAS 9.1 for Windows, SAS Institute Inc., Cary, North Carolina, USA). Die erhaltenen Datenreihen zu Konzentrationen verschiedener Mikroorganismen in den untersuchten Legehennenhaltungen wurden einer Varianzanalyse (one-way ANOVA) unterzogen. Ergab diese einen statistisch signifikanten F-Wert (p ≤ 0,05) wurde post hoc ein Tukey-HSD-Test durchgeführt um signifikante Unterschiede zwischen den Haltungsformen im Einzelnen aufzuzeigen.
3 Ergebnisse
Zwischen den einzelnen Haltungsformen wurden deutliche Unterschiede in den Konzentrationen der verschiedenen Gruppen luftgetragener Mikroorganismen gefunden (Gesamtbakterien: F = 15,82, p ≤ 0,0001; Staphylokokken: F = 18,45, p ≤ 0,0001; Enterokokken: F = 6,11, p = 0,000435). Zudem sind saisonale Verläufe und Abhängigkeiten vom Tieralter zu erkennen.
Bild 1 zeigt die Konzentrationen verschiedener Mikroorganismengruppen in der Luft der untersuchten Legehennenhaltungen.
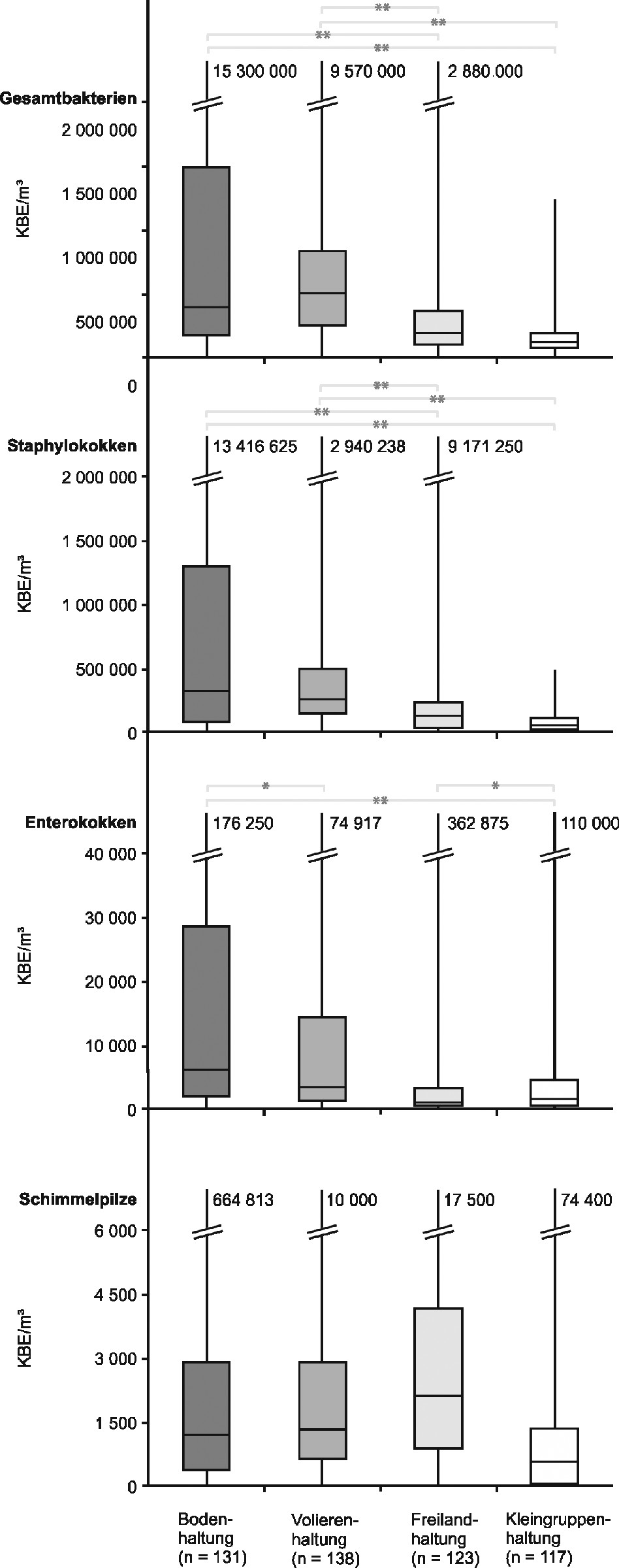
Bild 1. Box-and-Whisker-Plots der Konzentrationen verschiedener Mikroorganismengruppen in der Luft der untersuchten Legehennenhaltungen. Statistisch signifikante Unterschiede zwischen den einzelnen Haltungsformen (Tukey-HSD-Test) sind mit ** als hochsignifikant (p ≤ 0,01) und mit * als signifikant (p ≤ 0,05) angezeigt.
Foto: IFA
Es lässt sich ein deutlicher Unterschied in der durchschnittlichen Keimbelastung erkennen. Die höchsten Gehalte an Gesamtbakterien ließen sich regelmäßig in der Bodenhaltung und der Volierenhaltung feststellen. Meist deutlich niedrigere Werte fanden sich in der Freiland- und der Kleingruppenhaltung.
Bei den luftgetragenen Staphylokokken findet sich dasselbe Ranking. Dabei sind die Staphylokokken in ähnlich hohen Konzentrationen zu finden wie die Gesamtbakterien. Die Konzentrationen von Enterokokken liegen um durchschnittlich zwei Zehnerpotenzen niedriger und zeigen ähnliche Unterschiede zwischen den Haltungsformen. Allerdings zeigen sich hier auch signifikante Unterschiede zwischen Systemen mit Kotgrube (Bodenhaltung, Freilandhaltung). und Systemen mit regelmäßiger Kotbandentleerung (Volierenhaltung, Kleingruppenhaltung). Dies scheint auch für die Enterobakterien zu gelten, wobei sich tendenziell eine stärkere Belastung in der Boden- und der Freilandhaltung findet. Allerdings lagen die Konzentrationen im Bereich der unteren Nachweisgrenze des eingesetzten Verfahrens, sodass sie nicht quantifiziert werden konnten. Bei den Konzentrationen der luftgetragenen Schimmelpilze lassen sich keine eindeutigen Unterschiede zwischen den untersuchten Haltungssystemen erkennen. Relativ hohe Konzentrationen wurden am häufigsten in der Freilandhaltung gefunden, aber auch in den anderen Haltungsformen wurden regelmäßig und besonders in den Sommer- und Herbstmonaten Konzentrationen von mehr als 1 000 KBE Schimmelpilze pro Kubikmeter Luft ermittelt.
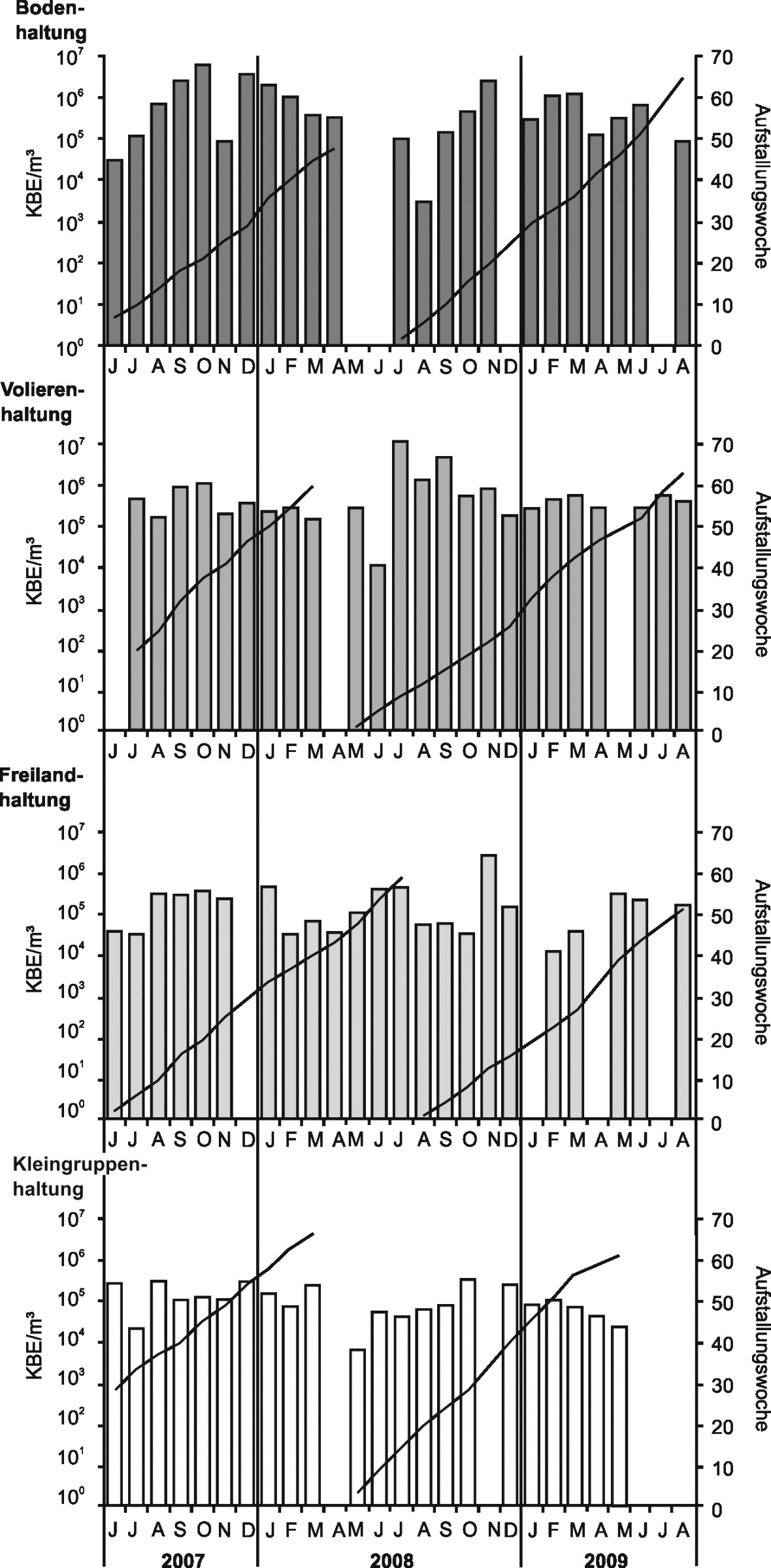
Bild 2 zeigt exemplarisch den saisonalen Verlauf der Staphylokokkenkonzentrationen in den vier Haltungssystemen über den gesamten Versuchszeitraum.
Es zeigt sich eine saisonale Abhängigkeit der Konzentrationen mit – bis auf die Volierenhaltung – den höchsten Werten in der kalten Jahreszeit, aber auch gegen Ende des Aufstallungszeitraums. Für Gesamtbakterien wurden ähnliche Verläufe festgestellt. Bei den Enterokokken war der saisonale Einfluss weniger deutlich ausgeprägt als der Einfluss der Aufstallungswoche mit höheren Konzentrationen am Ende der Legeperioden. Für die Enterobakterien waren aufgrund der niedrigen Konzentrationen im Bereich der unteren Nachweisgrenze saisonale oder aufstallungswochenbedingte Einflüsse nicht darstellbar. Die Schimmelpilzkonzentrationen zeigten sich unabhängig von der Aufstallungswoche mit deutlichem saisonalen Verlauf und höheren Konzentrationen in Sommer- und Herbstmonaten.
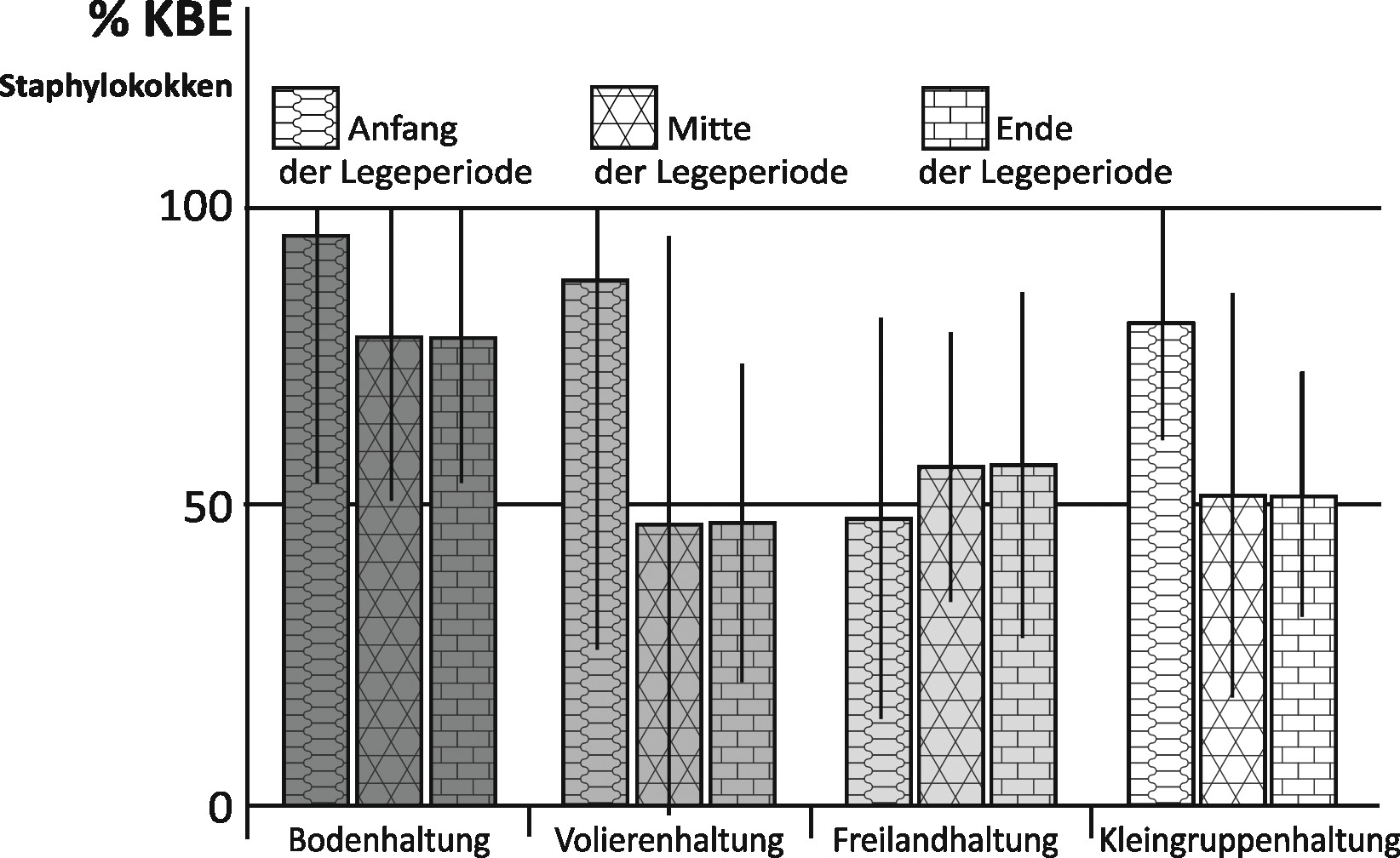
Den größten Anteil an den Gesamtbakterien machten in allen Haltungsformen die Staphyokokken aus, wobei sich die Höhe des Anteils unterschied (Bild 3).
Während bei der Bodenhaltung die Bakterienfracht der Luft zu einem gleichbleibend großen Anteil aus Staphylokokken zu bestehen scheint und diese auch bei der Volieren- und der Kleingruppenhaltung dominieren, machen Staphylokokken bei der Freilandhaltung durchschnittlich nur etwa 50 % der Gesamtbakterien aus.
4 Diskussion
Es zeigten sich deutliche Unterschiede in den vier untersuchten alternativen Haltungsformen für Legehennen bezüglich der Konzentrationen luftgetragener Mikroorganismen.
Bis auf die Schimmelpilze weist die Kleingruppenhaltung die niedrigsten Konzentrationen auf, die Bodenhaltung regelmäßig die höchsten. Ist den Hennen der Zugang zu Scharrgut verwehrt, wie z. B. in der Eingewöhnungsphase, waren die Keimkonzentrationen auch dort niedriger. Eine vergleichbare Rangfolge in den Bakterienkonzentrationen von der Bodenhaltung bis zur Kleingruppenhaltung fanden auch andere Autoren [14]: Die Konzentrationen fielen in der Bodenhaltung signifikant höher aus als in einem System mit mehreren Etagen (vgl. Voliere) oder in ausgestalteten Käfigen (vgl. Kleingruppenhaltung). Die Konzentrationen lagen dabei in etwa den gleichen Größenordnungen wie in der vorliegenden Untersuchung.
In den beiden Systemen mit innen liegendem Scharrraum (Boden- und Volierenhaltung) wurden höhere Konzentrationen luftgetragener Mikroorganismen ermittelt als in den Systemen ohne oder mit außen liegendem Scharrbereich. Die Lage der Scharrfläche und die Art des Scharrguts scheinen somit einen Einfluss auf den Mikroorganismengehalt der Luft haben. Staphylokokken zeigten sich hier als die vorherrschende Gruppe von Mikroorganismen, obschon sich deren prozentualer Anteil an den Gesamtbakterien unter den vier Haltungsformen unterschied. Der Anteil Staphylokokken ist besonders im ersten Drittel der Legeperiode hoch. Da als Quelle für Staphylokokken vornehmlich Haut- und Schleimhautoberflächen der Tiere infrage kommen, kann davon ausgegangen werden, dass unmittelbar nach der Einstallung die Tiere die Hauptquelle für Bioaerosole sind und im Laufe der Zeit das Bakterienspektrum um weitere Bakteriengattungen anderer Herkunft (Kot, wenn vorhanden Einstreu, Futterreste) erweitert wird.
Die hier ermittelten Schimmelpilzkonzentrationen lagen im für die Geflügelhaltung üblichen Bereich [15; 16] und waren bis auf wenige Ausnahmen im Bereich der natürlichen Hintergrundkonzentration anzusiedeln [17 bis 20]. Es kann somit davon ausgegangen werden, dass die gefundenen Schimmelpilze in der Stallluft zu großen Anteilen mit der Frischluft aus der Umwelt eingetragen wurden und Unterschiede in den Konzentrationen weniger von der Art der Haltungsform als vielmehr von der individuellen Umgebung der Tierställe abhängen. Auch andere Autoren fanden einen großen saisonalen Einfluss auf die Konzentrationen von Schimmelpilzen, der sich auch in den Schimmelpilzkonzentrationen in der Außenluft widerspiegelte [21]. Allerdings fanden sich dabei insgesamt höhere Schimmelpilzkonzentrationen in den eingestreuten Systemen.
Die Kleingruppenhaltung zeigte insgesamt die niedrigsten Konzentrationen von luftgetragenen Mikroorganismen. Dies ist wahrscheinlich darauf zurückzuführen, dass den Hennen hier nur einmal am Tag eine kleine Menge staubarmes Streugut auf der dafür vorgesehenen Sandbadematte zur Verfügung gestellt wurde. Dieses Streugut war meist innerhalb einer halben Stunde verbraucht, während den Hennen in den übrigen Haltungsformen ständig ein tief eingestreuter Bereich zum Scharren und Sandbaden zur Verfügung stand, in dem sich im Laufe der Legeperiode der Anteil an Kot-, Feder- und Hautpartikel zunehmend erhöhte.
In diesem Zusammenhang scheint auch das Fäkalmanagement insgesamt einen Einfluss auf die Befrachtung der Stallluft zu haben, da die durchschnittlichen Konzentrationen von Mikroorganismen mit fäkalem Ursprung in den beiden untersuchten Systemen mit Kotgrube (Bodenhaltung und Freilandhaltung) höher waren als in den beiden Systemen mit regelmäßig entleertem Kotband.
Darüber hinaus scheint es auch Faktoren zu geben, die eine grundsätzliche Unterscheidung des Bakterienspektrums in der Luft der verschiedenen Haltungsformen bedingen. Hierbei scheint auch dem unterschiedlich ausgeprägten Eintrag von Mikroorganismen aus dem Umfeld der Ställe eine Bedeutung zuzukommen.
5 Fazit
Je nach Haltungssystem sind Beschäftigte in der Legehennenhaltung unterschiedlich hohen Konzentrationen und Zusammensetzungen von luftgetragenen Mikroorganismen ausgesetzt. Dabei sind Haltungssysteme mit beschränktem Zugang zu Scharrgut und eingeschränkter Bewegungsfähigkeit aus Sicht des Arbeitsschutzes als günstiger einzustufen. Die uneingeschränkte Ausübung natürlicher Verhaltensweisen der Hühner, wie Staubbaden oder Scharren, sollte jedoch Bestandteil tiergerechter Haltung sein. Möglicherweise kann eine räumliche Trennung der Futter-, Eiablage- und Scharreinrichtungen dazu beitragen, dass Tierbewegungen, die nicht unmittelbar mit Staubbade- oder Scharrverhalten verknüpft sind, weniger mikroorganismenbehaftete Partikel aufwirbeln. Festzuhalten bleibt somit, dass – neben den Einflüssen durch Jahreszeit und Tieralter – mit der Lage und der Beschickung des Scharrraums oder dem Fäkalmanagement auch bauliche und organisatorische Maßnahmen denkbar sind, mit denen die luftgetragenen Konzentrationen von Mikroorganismen und damit die Risiken sowohl für die Gesundheit der Beschäftigten als auch der Tiere reduziert werden können.
Literatur
- Riethmüller, A.: Prävention von Erkrankungen der Atemwege durch Bioaerosole in der Landwirtschaft und damit verbundener Bereiche. Vortrag B2-Seminar, DGUV-Akademie Dresden 2014.
- Brooks, S. M.; Truncale, T.; McCluskey, J.: Occupational and environmental asthma, In: Rom, W. N.; Markowitz, S. B. (Hrsg.): Environmental and occupational medicine, S. 418-465. Philadelphia: Lippincott Williams & Wilkins 2007.
- Morris, P. D.; Lenhart, S. W.; Service, W. S.: Respiratory symptoms and pulmonary function in chicken catchers in poultry confinement units. Am. J. Ind. Med. 19 (1991), S. 195-204.
- Danuser, B.; Weber, C.; Künzli, N.; Schindler, C. H.; Nowak, D.: Respiratory symptoms in Swiss farmers: an epidemiological study of risk factors. Am. J. Ind. Med. 39 (2001), S. 410-418.
- Zuskin, E.; Mustajbegovic, J.; Schachter, E. N.; Kern, J.; Rienzi, N.; Goswami, S.; Marom, Z.; Maayani, S.: Respiratory function in poultry workers and pharmacologic characterization of poultry dust extract. Environ. Res. 70 (1995), S. 11-19.
- Elbers, A. R.; Blaauw, P. J.; de Vries, M. J.; van Gulick, P. J.; Smithuis, O. L.; Gerrits, R. P.; Tielen, M. J.: Veterinary practice and occupational health – an epidemiological study of several professional groups of Dutch veterinarians. 1. General physical examination and prevalence of allergy, lung function disorders and bronchial hyperreactivity. Vet. Q. 18 (1996), S. 127-131.
- Qi, R.; Manbeck, H. B.; Maghirang, R. G.: Dust net generation rate in a poultry layer house. Trans. ASAE 35 (1992) Nr. 5, S. 1639-1645.
- Aarnink, A. J. A.; Stockhofe-Zurwieden, N.; Wagemans, M. J. M.: Dust in different housing systems for growing-finishing pigs. In: Proceedings of the AgEng 2004 Conference Engineering the future. 12.-16. September 2004, Leuven, Belgien.
- Hartung, J.; Schütz, A.; Klasmeier, E.; Seedorf, J.: PM10 measurements in a turkey barn. In: Proceedings of the International Conference of the Society of Animal Hygiene. Warschau, Polen 2004.
- Rieger, M. A.; Sundrum, A.; Jungbluth, T.; Hartung, E.: Beurteilung der Lungengesundheit von Schweinen aus verschiedenen ökologischen Haltungssystemen mittels BAL und Lungenhistologie. Abschlussbericht Projekt 03 OE 370. Wuppertal 2005. www.orgprints.org/9185/
- VDI 4252 Blatt 3: Erfassen luftgetragener Mikroorganismen und Viren in der Außenluft – Aktive Probenahme von Bioaerosolen – Abscheidung von luftgetragenen Bakterien mit Impingern nach dem Prinzip der kritischen Düse. Berlin: Beuth 2008.
- VDI 4250 Blatt 1: Bioaerosole und biologische Agenzien – Umweltmedizinische Bewertung von Bioaerosol-Immissionen – Wirkungen mikrobieller Luftverunreinigungen auf den Menschen. Berlin: Beuth 2014.
- VDI 4250 Blatt 3: Bioaerosole und biologische Agenzien – Anlagenbezogene umweltmedizinisch relevante Messparameter und grundlegende Beurteilungswerte. Berlin: Beuth 2014.
- Nimmermark, S.; Lund, V.; Gustafsson, G.; Eduard, W.: Ammonia, dust and bacteria in welfare-oriented systems for laying hens. Ann. Agric. Environ. Med. 16 (2009), S. 103-113.
- Wang, Y.; Lu, G.; Zhang, X.; Ma, R.; Chai, T.: Biodiversity and concentration of airborne fungi in chicken houses. In: Aland, A. (Hrsg.): Proceedings of the XIIIth ISAH Congress. Tartu, Estland 2007.
- Plewa, K.; Lonc, E.: Analysis of airborne contamination with bacteria and moulds in poultry farming: a case study. Polish J. Environ. Stud. 20 (2011) Nr. 3, S. 725-731.
- Kolk, A.: Verfahren zur Bestimmung der Bakterienkonzentration in der Luft am Arbeitsplatz (Kennzahl 9430). In: IFA- Arbeitsmappe Messung von Gefahrstoffen. 2. Lfg. X/2013. Hrsg.: Deutsche Gesetzliche Unfallversicherung. Berlin: Erich Schmidt – Losebl.-Ausg. 1989.
- Sautour, M.; Sixt, N.; Dalle, F.; L’Ollivier, C.; Fourquenet, V.; Calinon, C.; Paul, K.; Valvin, S.; Maurel, A.; Aho, S.; Couillault, G.; Cachia, C.; Vagner, O.; Cuisenier, B.; Caillot, D.; Bonnin, A.: Profiles and seasonal distribution of airborne fungi in indoor and outdoor environments at a French hospital. Sci. Total Environ. 407 (2009) Nr. 12, S. 3766-3771.
- Shelton, B. G.; Kirkland, K. H.; Flanders, W. D.; Morris, G. K.: Profiles of airborne fungi in buildings and outdoor environments in the United States. Appl. Environ. Microbiol. 68 (2002) Nr. 4, S. 1743-1753.
- Medrela-Kuder, E.: Seasonal variations in the occurrence of culturable air-borne fungi in outdoor and indoor air in Craców. Int. Biodeter. Biodegrad. 52 (2003), S. 203-205.
- Sowiak, M.; Bródka, K.; Kozajda, A.; Buczynska, A.; Szadkowska-Stanczyk, I.: Fungal aerosol in the process of poultry breeding – quantitative and qualitative analysis. Med. Pr. 63 (2012) Nr. 1, S. 1-10.
Danksagung
Die Messwerte entstammen aus dem finanziell durch das Niedersächsische Ministerium für Ernährung, Landwirtschaft, Verbraucherschutz und Landesentwicklung über die Bundesanstalt für Landwirtschaft und Ernährung unterstützten Forschungsvorhaben 05HS012.
Dr. Annette Clauß, geb. Springorum, Dr. Marcus Clauß, Dr. Torsten Hinz - Thünen-Institut für Agrartechnologie, Braunschweig.
Prof. Dr. Monika A. Rieger, Institut für Arbeitsmedizin, Sozialmedizin und Versorgungsforschung, Eberhard Karls Universität, Tübingen.
Prof. Dr. Jörg Hartung, Institut für Tierhygiene, Tierschutz und Nutztierethologie, Stiftung Tierärztliche Hochschule Hannover.