Warum manche Prothesen und Implantate früher ausgetauscht werden müssen
Die Empa-Forscherin Martina Cihova untersucht, wie Titan-Implantate mit dem Körper reagieren, warum sie manchmal abgestoßen oder korrodieren und wie modernste Forschung die Lebensqualität der Patientinnen und Patienten verbessert.
Forschung an Implantaten: Struktur und Reaktivität der Titanoxid-Oberfläche im Fokus.
Foto: PantherMedia / monstArrr
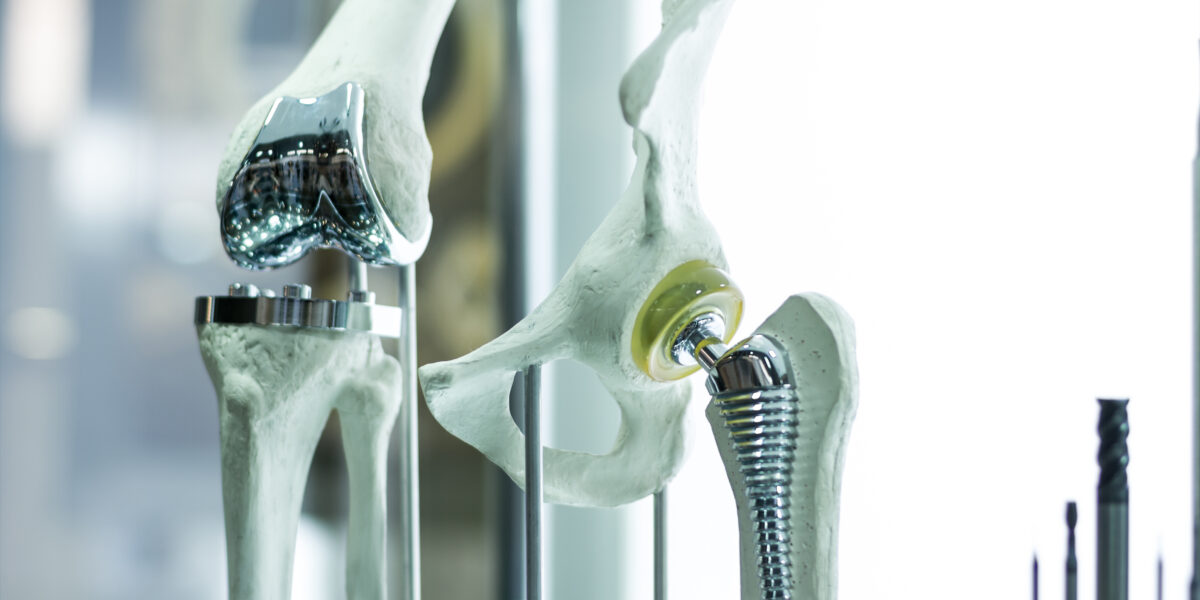
Dank moderner Medizin leben wir Menschen immer länger. Gleichzeitig möchten wir bis ins hohe Alter gesund und beweglich bleiben. Implantate und Prothesen ersetzen abgenutzte Gelenke oder Zähne, lindern Schmerzen und verbessern die Lebensqualität. Moderne Implantate sind echte Meisterwerke der Biomaterial- und Bioingenieurskunst. Doch manchmal versagen sie. Und das hat Folgen für die Patientinnen und Patienten.
Titan-Implantate helfen vielen Menschen – doch manchmal stößt der Körper sie ab oder sie gehen kaputt. Warum das passiert, erforscht die Empa-Wissenschaftlerin Martina Cihova. Sie arbeitet an der Schnittstelle von Medizin und Materialwissenschaft und untersucht genau, wie Implantat und Körper zusammenwirken. Für dieses Projekt hat sie vor Kurzem einen «Ambizione-Grant» des Schweizerischen Nationalfonds (SNF) erhalten.

Das Rasterkraftmikroskopbild zeigt verschiedene Bereiche mit unterschiedlichem Oberflächenpotenzial, die durch Laserbearbeitung des Titanoxids entstanden sind.
Foto: Empa
Titan im Körper: Stabilität dank winziger Oxidschicht
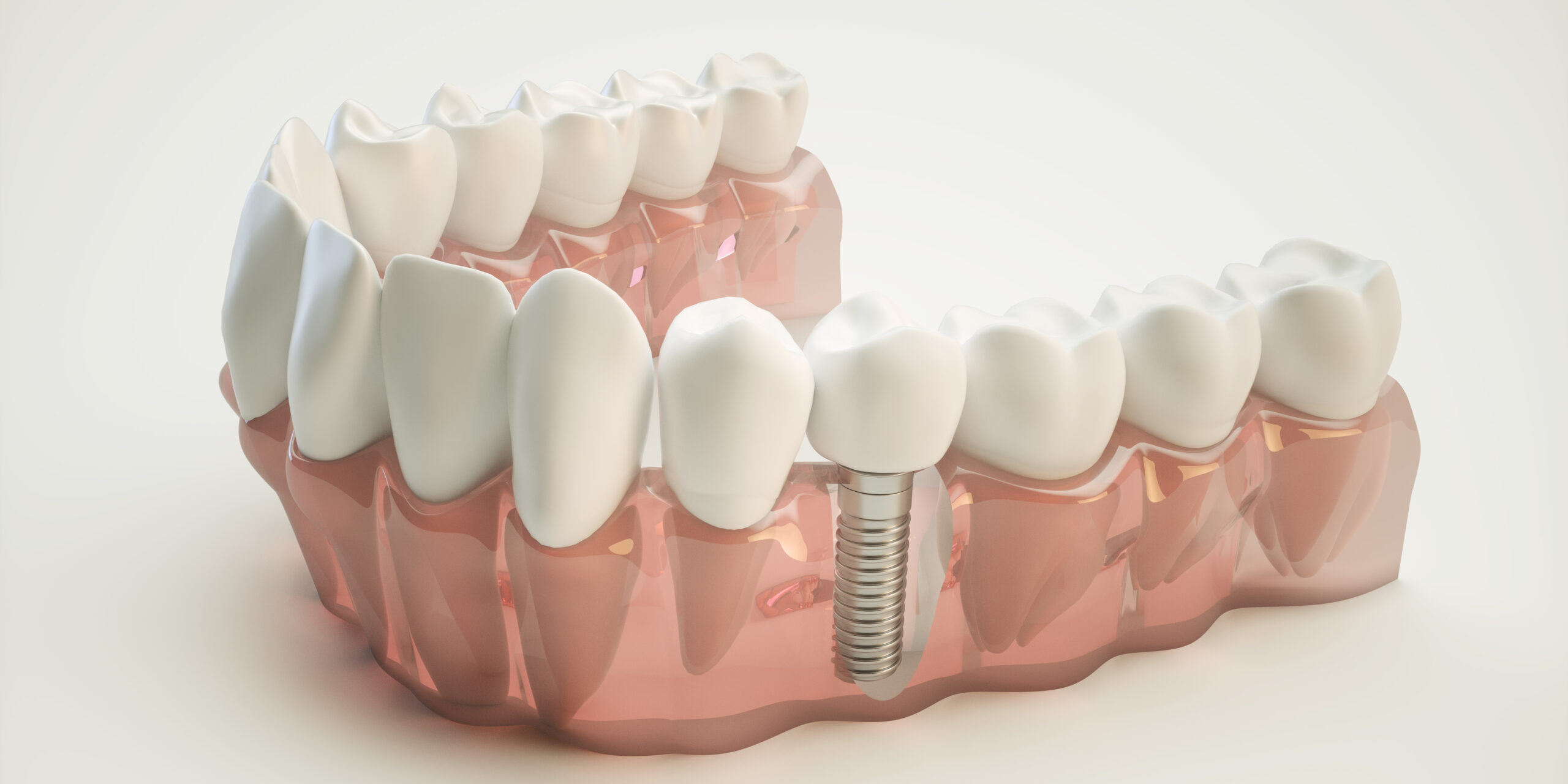
Viele Implantate wie künstliche Gelenke, Zahnimplantate oder Herzschrittmacher bestehen aus Titan. Dieses Metall ist leicht, stabil und sehr beständig im Körper. Zudem verbindet es sich gut mit Knochen. Verantwortlich dafür ist eine dünne Schicht aus Titanoxid, die sich automatisch an der Oberfläche bildet, sobald Titan mit Luft in Berührung kommt. Im Körper ist also nicht das Titan selbst entscheidend, sondern diese schützende Oxidschicht. „Da diese natürliche Passivschicht weniger als zehn Nanometer dick ist, wird sie in der Medizintechnologie und Forschung oft zu wenig beachtet“, erklärt Martina Cihova.
Manche Hersteller verändern die Oxidschicht von Implantaten, zum Beispiel indem sie sie verdicken, um Implantatgrößen oder -modelle farblich zu kennzeichnen. Das erleichtert Ärztinnen und Ärzten die Arbeit. Andere bearbeiten die Oberfläche so, dass der Knochen besser anwachsen kann, oder gravieren mit einem Laser die Seriennummer ein. Sogar patientenspezifische Implantate können heute mit Laserverfahren im 3D-Druck hergestellt werden.
All diese Anwendungen seien zwar sinnvoll, betont Cihova. Doch jede Oberflächenbehandlung könne die Oxidschicht auf dem Titan verändern. Noch sei zu wenig bekannt, welche Folgen das für die Wechselwirkung zwischen Implantat und Körper sowie für die Beständigkeit gegen Korrosion habe.
Auch interessant: Wenn Implantate sich im Körper einfach auflösen
Von der Materialwissenschaft zur Medizin
Schon im Bioingenieur-Studium entdeckte Cihova ihre Leidenschaft für Materialwissenschaften. Für ihre Doktorarbeit wandte sie sich deshalb der Metallurgie zu, um ihr Wissen über Materialien zu vertiefen. Heute verbindet sie beide Fachgebiete und konzentriert sich genau auf die Schnittstelle, an der Metall und Biologie zusammentreffen: die Grenzfläche zwischen Implantat und menschlichem Körper.
Die Jungforscherin erklärt, solche Biogrenzflächen seien zwar sehr komplex, aber zugleich äußerst spannend. Normalerweise denke man bei Korrosion an salziges Meerwasser, feuchte Luft oder ein rostiges Velo – jedoch kaum an den menschlichen Körper.

Empa-Forscherin Martina Cihova.
Foto: Empa
Die Herausforderung Biokorrosion
Der menschliche Körper kann für Implantate eine überraschend aggressive Umgebung sein – besonders dann, wenn Immunreaktionen ablaufen. Immunzellen setzen Stoffe frei, die zum Beispiel den pH-Wert senken und dadurch das Implantat angreifen. Die zentrale Frage lautet also: Wie geht der Körper mit Materialien um, die wir eigentlich für stabil halten? Genau damit beschäftigt sich die Forschung zur Biokorrosion.
Diese Prozesse sind sowohl chemisch als auch biologisch sehr komplex. Hinzu kommt, dass Titanoxid nicht immer gleich ist. Obwohl es chemisch immer aus TiO₂ besteht, kann es in drei verschiedenen kristallinen Formen auftreten – oder in einer amorphen, also ungeordneten Struktur. Diese Varianten unterscheiden sich in ihren elektronischen und elektrochemischen Eigenschaften und damit möglicherweise auch in ihrer Reaktion mit dem Körper.
Implantatoberflächen unter der Lupe: Vom Labor zur Biologie
Die Behandlung der Implantatoberflächen kann die Kristallformen des Titanoxids verändern – entweder auf der ganzen Oberfläche oder nur an einzelnen Stellen. Um zu verstehen, wie diese Unterschiede die ohnehin komplexe Biogrenzfläche beeinflussen, geht Cihova systematisch vor. Zusammen mit Empa-Experten für Laserverarbeitung in Thun stellen sie Mustersubstrate mit unterschiedlich strukturierten Titanoxidschichten her. Diese Substrate werden dann schrittweise immer komplexeren Körperflüssigkeiten ausgesetzt, um genau zu untersuchen, wie Struktur, Eigenschaften und Reaktivität der Oxide zusammenhängen.
„Wir beginnen mit simulierten physiologischen Flüssigkeiten, die lediglich Wasser und Ionen enthalten“, sagt die Forscherin. Im nächsten Schritt wollen die Forschenden Proteine untersuchen, zum Beispiel Fibrinogen, das bei der Immunantwort und Wundheilung eine Rolle spielt. Anschließend planen sie zu prüfen, wie sich die Biogrenzfläche in Kontakt mit lebenden Makrophagen – den „Polizisten des Körpers“ – verhält.
Bei jedem dieser Schritte werden die Grenzflächen gründlich untersucht, mit elektrochemischen Methoden sowie hochauflösender Elektronen- und Rasterkraftmikroskopie.
Lesen Sie auch: Beschichtung macht Implantate intelligent
Ein Beitrag von: