Nanomaterial bringt Krebszellen dazu, sich selbst zu zerstören
Neues Nanomaterial nutzt die Chemie von Tumoren und bringt Krebszellen durch oxidativen Stress gezielt zum Absterben.
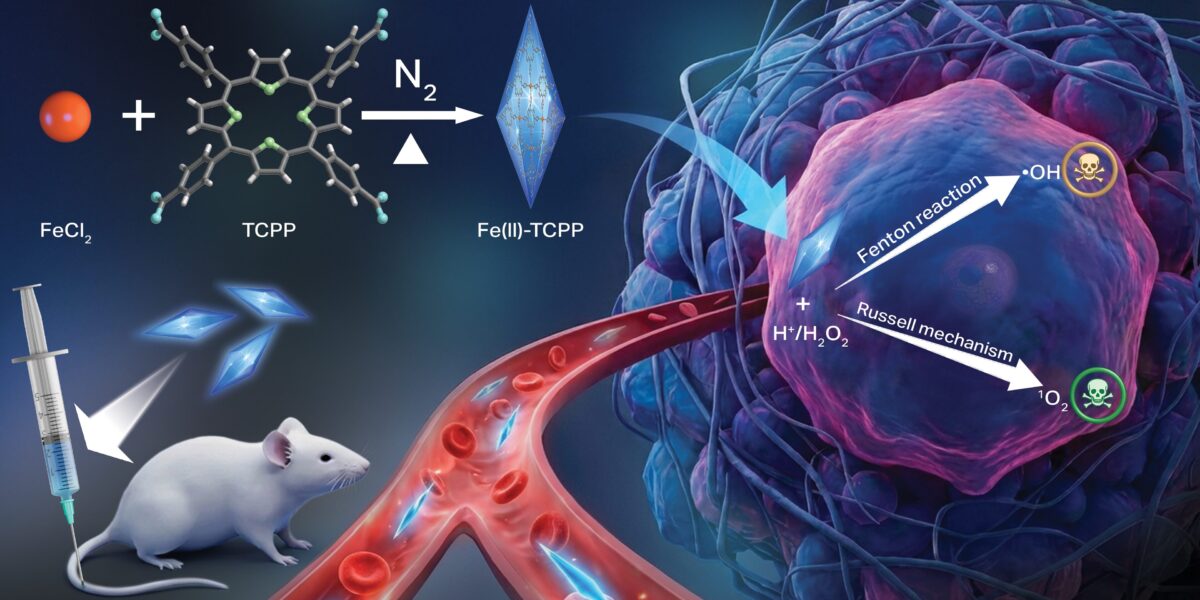
Wissenschaftler der Oregon State University haben ein neues Nanomaterial entwickelt, das in Krebszellen zwei chemische Reaktionen auslöst, wodurch die Zellen durch oxidativen Stress abgetötet werden, während gesundes Gewebe verschont bleibt.
Foto: Graphic by Parinaz Ghanbari
| Das Wichtigste in Kürze |
|
Krebszellen unterscheiden sich chemisch deutlich von gesundem Gewebe. Genau diesen Unterschied nutzen Forschende der Oregon State University jetzt gezielt aus. Sie haben ein Nanomaterial entwickelt, das in Tumorzellen eine Kettenreaktion auslöst – und die Zellen dadurch abtötet, ohne umliegendes Gewebe ernsthaft zu schädigen.
Die Studie stammt von Oleh und Olena Taratula sowie Chao Wang vom College of Pharmacy der Universität. Veröffentlicht wurde sie in Advanced Functional Materials. Im Zentrum steht ein neuer Ansatz der sogenannten chemodynamischen Therapie, kurz CDT.
Inhaltsverzeichnis
Wenn Krebszellen ihre Schwäche verraten
Tumorgewebe hat eine besondere chemische Umgebung. Es ist meist saurer als gesundes Gewebe und enthält erhöhte Mengen an Wasserstoffperoxid. Für herkömmliche Therapien ist das oft ein Problem. Für CDT ist es eine Chance.
Die Methode nutzt diese Bedingungen, um reaktive Sauerstoffverbindungen direkt im Tumor zu erzeugen. Diese Moleküle greifen Zellbestandteile wie Membranen, Proteine und DNA an. Der entstehende oxidative Stress ist für Krebszellen besonders gefährlich.
Bisherige CDT-Wirkstoffe hatten allerdings klare Grenzen. Sie erzeugten meist nur eine Art dieser aggressiven Sauerstoffverbindungen – und oft nicht dauerhaft genug. Oleh Taratula sagt dazu:
„Allerdings sind die vorhandenen CDT-Wirkstoffe begrenzt.“
Zwei Reaktionen statt einer
Das neue Material geht einen Schritt weiter. Es handelt sich um ein eisenbasiertes metallorganisches Gerüst, ein sogenanntes MOF. Dieses Nanomaterial kann gleich zwei unterschiedliche reaktive Sauerstoffspezies erzeugen. Dadurch steigt der chemische Druck auf die Krebszellen deutlich.
Im Labor zeigte sich das schnell. Mehrere Krebszelllinien reagierten empfindlich auf den Wirkstoff. Gesunde Zellen blieben weitgehend unbeeinträchtigt.
Vollständige Tumorrückbildung bei Mäusen
Besonders aufschlussreich sind die Tierversuche. Die Forschenden verabreichten den Nanowirkstoff Mäusen mit menschlichen Brustkrebszellen. Das Material sammelte sich gezielt im Tumor an und setzte dort reaktive Sauerstoffverbindungen frei.
Olena Taratula beschreibt das Ergebnis so: „Wir beobachteten eine vollständige Tumorregression und eine langfristige Verhinderung von Rezidiven, ohne dass eine systemische Toxizität auftrat.“ Nebenwirkungen traten nicht auf. Auch gesundes Gewebe blieb unauffällig.
Noch ein weiter Weg bis zur Klinik
So klar die Ergebnisse im Tiermodell sind, so wichtig ist die Einordnung. Die Methode ist nicht reif für den Einsatz beim Menschen. Als Nächstes will das Team prüfen, ob der Ansatz auch bei anderen Tumorarten funktioniert, etwa bei aggressivem Bauchspeicheldrüsenkrebs.
Sollte sich das bestätigen, könnte CDT künftig eine neue Rolle in der Krebstherapie spielen – als Ergänzung zu bestehenden Verfahren, nicht als Ersatz.
Ein Beitrag von:








