Biozidanwendung bei Schimmelpilzschäden
Zusammenfassung Obwohl die meisten offiziellen Stellen und Fachgesellschaften deutlich davon abraten, werden nach wie vor häufig Biozide zur Behandlung und Sanierung von Schimmelpilzschäden in Innenräumen verwendet. Trotz vieler Studien gibt es bisher keinen Nachweis dafür, dass sich Schimmelbefälle in oder auf Baumaterialien durch Biozidbehandlungen nachhaltig beseitigen lassen. Neben dieser in der Praxis fehlenden Wirksamkeit auf die Mikroorganismen sprechen weitere Faktoren gegen die Verwendung von Bioziden in Innenräumen: Von ihnen können direkte und indirekte Gesundheitsgefahren für die Gebäudenutzer ausgehen. Außerdem besteht die Möglichkeit, dass die Schimmelpilze mit einer verstärkten Freisetzung von Mykotoxinen auf die Biozide reagieren. Somit ergibt sich eine, aus gesundheitlicher Sicht als gefährdend einzuschätzende Expositionssituation für die Personen, die sich in den Räumen aufhalten. Diese Fragen bekommen auch dadurch neue Brisanz, dass sich zurzeit sämtliche Biozidprodukte zur Schimmelpilzbekämpfung unter Übergangsregelungen auf dem Markt befinden und demnächst neu zugelassen werden müssen, wofür jedoch keine für den Baubereich angepassten Testverfahren zur Verfügung stehen.

Schimmel in einer Wohnung .
Foto: PantherMedia/Heiko119
1 Einleitung
1.1 Einsatz von Bioziden im Zusammenhang mit Feuchte- und Schimmelschäden
Schon im „Schimmelpilz-Sanierungsleitfaden“ von 2005 [1] und in einer Presseinformation von 2009 [2] hat das Umweltbundesamt (UBA) deutlich davon abgeraten, Schimmelpilzschäden mit Bioziden, die in diesem Zusammenhang oft fälschlicherweise als „Desinfektionsmittel“ bezeichnet werden, zu behandeln. Im aktuellen Entwurf des UBA-Schimmelleitfadens [3] wird noch einmal ausführlich dargestellt, warum eine routinemäßige Verwendung von Bioziden zur Beseitigung von Schimmelschäden nicht zielführend ist.
In all diesen Empfehlungen spielen in Bezug auf die Biozidanwendung bei Schimmelpilzschäden im Wesentlichen drei Aspekte eine Rolle: Zum einen gibt es bislang keine aussagekräftigen Studien, ob durch den Einsatz von Bioziden überhaupt eine signifikante Abtötung von Mikroorganismen in und auf Baumaterialien erzielt werden kann. Zum anderen gehen die im Zusammenhang mit Schimmelpilzexpositionen relevanten Gesundheitseffekte, zu denen vor allem sensibilisierende Wirkungen und irritative Effekte im Bereich der Atemwege gehören, genauso von abgestorbenen Pilzbestandteilen wie von lebenden Zellen aus [4]. Schließlich wird vor allem aus Sicht des Arbeitsschutzes, aber auch in Bezug auf die Gesundheit der Gebäudenutzer vor den gesundheitsschädigenden Wirkungen durch die Biozidprodukte selbst gewarnt. Die Praxis zeigt jedoch, dass diese Empfehlungen häufig nicht eingehalten werden. So werden auch bei massiven Schimmelschäden von angeblich sachverständigen Schimmelpilzsanierern ganze Räume mit Desinfektionsmitteln eingenebelt oder Fußbodenaufbauten damit geflutet. Es gibt also nach wie vor viele Firmen, die „Schimmelpilzsanierungen“ bewerben und anbieten, die ausschließlich mit „Desinfektionsmitteln“ arbeiten, anstatt die notwendige Beseitigung der Ursachen für das Schimmelpilzwachstum vorzunehmen. Eine von uns vorgenommene Internetrecherche ergab für den Suchbegriff „Schimmelpilzsanierung“ auf den ersten beiden Seiten der Trefferliste elf Firmen, die Biozide einsetzen, von denen vier ausschließlich Biozidbehandlungen anbieten und keine anderen Verfahren im Angebot haben. Für den Suchbegriff „Schimmelpilzbeseitigung“ lieferten die ersten beiden Trefferseiten 14 Firmen, die mit Bioziden arbeiten, von denen neun ausschließlich den Einsatz von Bioziden vorsehen. Bei der Suche zu „Schimmelpilzbefall entfernen“ erschienen auf den ersten beiden Seiten 22 Firmen, die Biozidbehandlungen anbieten, von denen elf für diese Aufgabe ausschließlich Biozide verwenden.
1.2 Zulassung von Bioziden zur Schimmelpilzbekämpfung
Das Inverkehrbringen und Verwenden von Biozidprodukten ist auf europäischer Ebene geregelt und bedarf einiger Voraussetzungen. Grundsätzlich dürfen nur zugelassene Biozidprodukte auf den Markt gebracht werden. Eine Zulassung ist nur dann möglich, wenn die enthaltenen Wirkstoffe (aktive Substanzen) auch für die jeweilige Produktart genehmigt sind. Daher muss nach Biozid-Verordnung [5] für alle aktiven Substanzen eines Biozidprodukts eine Bewertung vorliegen, welche die Wirksamkeit gegen die Zielorganismen sowie mögliche Auswirkungen auf Menschen, Tiere und auf die Umwelt darlegt. Diese Überprüfung erfolgt nach Kriterien, die auf europäischer Ebene einheitlich festgelegt wurden.
Für Biozidprodukte, deren Wirkstoffe bereits vor der Anwendung der aktuellen Biozid-Verordnung [5] und ihrer Vorläufer-Richtlinie [6] auf dem Markt waren, existiert eine Übergangsregelung. Ordnungsgemäß nach Biozid-Meldeverordnung [7] und Chemikaliengesetz [8] gemeldete Produkte, die dieser Übergangsregelung unterliegen, sind in Deutschland bis zur Entscheidung über die Genehmigung der enthaltenen Altwirkstoffe zulassungsfrei verkehrsfähig. Ist für die eingesetzten Altwirkstoffe eine Genehmigung erteilt, so verliert das Biozidprodukt mit einem festen Stichtag seine Verkehrsfähigkeit, kann jedoch mit einer Frist abverkauft und noch genutzt werden. Soll das Biozidprodukt seine Verkehrsfähigkeit behalten, muss ein Zulassungsverfahren eingeleitet werden. Biozidprodukte können, auch wenn sie nach Biozid-Meldeverordnung [7] bis zum Stichtag verkehrsfähig waren, nicht automatisch eine Zulassung nach Biozid-Verordnung [5] erhalten. Grund dafür ist, dass die für eine Zulassung erforderliche Bewertung der Wirksamkeit in der Übergangsregelung nicht notwendig war. Dies ist nun nachzuholen.
Die meisten Biozidprodukte zur Schimmelpilzbekämpfung befinden sich zurzeit unter dieser Übergangsregelung auf dem Markt. So sind derzeit ca. 1 000 Biozidprodukte in der Datenbank der Biozid-Meldeverordnung [7] gelistet, aus deren Handelsnamen sich der Einsatz zur Schimmelpilzbeseitigung als Mittel zur Behandlung von Oberflächen, der Luft, aber auch als Anti-Schimmelfarbe direkt ableiten lässt. Davon ist bisher nur ein Produkt zugelassen. Weitere acht Produkte, die den Wirkstoff Wasserstoffperoxid (H2O2) mit dem Stichtag vom 1. Februar 2017 enthalten, befinden sich derzeit im Zulassungsverfahren. Keines dieser Produkte wird in der Schimmelschadensanierung eingesetzt.
Mit dem Stichtag vom 1. Oktober 2017 bedürfen alle Produkte mit Peressigsäure als aktivem Wirkstoff einer Zulassung, und ab dem 1. Januar 2019 gilt dies für Biozidprodukte auf Aktivchlorbasis. Altwirkstoffe, für die bisher keine Genehmigung erteilt ist, bleiben vorbehaltlich weiterer Entscheidungen bis zum 31. Dezember 2024 verkehrsfähig. Diese unterschiedlichen Fristen ergeben sich dadurch, dass die einzelnen Wirkstoffe innerhalb der Europäischen Union (EU) nacheinander bewertet werden.
Um die Wirksamkeit von Bioziden nachzuweisen, muss ein dreistufiges Prüfregime durchlaufen werden. Zunächst muss in der Stufe 1 die Wirksamkeit der aktiven Substanz beschrieben werden. In der Stufe 2 muss in quantitativen Versuchen unter praxisnahen Bedingungen die Wirksamkeit des Wirkstoffs in der jeweiligen Produktanwendung belegt werden. Stufe 3 umfasst Feldstudien und Praxistests. Dazu hat die europäische Chemikalienagentur (ECHA) eine Richtlinie [9] herausgegeben, wie für die einzelnen Anwendungen vorzugehen ist und welche Normen hierbei relevant sind. Für die Wirksamkeitsprüfungen von Bioziden im Baubereich existieren jedoch keine standardisierten Testverfahren. Daher wird – unter anderem auch deshalb, weil der Ursprung der Desinfektion im medizinischen Bereich liegt – auf Prüfungen mit Hygieneanwendungen im Gesundheitswesen zurückgegriffen. Die Ergebnisse aus diesen Anwendungsfeldern lassen sich jedoch weder in Bezug auf die gewünschte Wirkung gegen die Zielorganismen noch in Bezug auf die möglichen Gesundheitsgefahren übertragen. So werden z. B. mit alkoholbasierten Desinfektionsmitteln in den Gesundheitseinrichtungen grundsätzlich nur kleine Flächen zur Schnell- bzw. Zwischendesinfektion bearbeitet. Bei einem Ausbringen dieser Mittel in größerem Maßstab oder gar ihrem Versprühen bzw. Vernebeln in Gebäuden wäre aufgrund der leichten Entzündbarkeit von Alkohol eine massive Brand- und Explosionsgefahr gegeben. Arbeitsplatzmessungen der Berufsgenossenschaft der Bauwirtschaft (BG BAU) zeigen, dass bei einem großflächigen Aufbringen von Desinfektionsmitteln auf Wasserstoffperoxidbasis im Sprühverfahren eine vielfache Überschreitung des Arbeitsplatzgrenzwertes von 0,7 mg/m3 auftreten kann. Im Bereich des Infektionsschutzes wird H2O2 hingegen nur sehr selten für ganz spezielle Anwendungen in kleinen Mengen eingesetzt.
1.3 Klassifikation und Wirkmechanismen von Bioziden
Biozide sind Wirkstoffe, die auf chemische Weise in die Physiologie von Mikroorganismen (Target) eingreifen, sodass diese ihre Lebensfunktionen einstellen. In der Folge kommt es zu einer Hemmung der Fortpflanzung, Inaktivierung von Stoffwechselprozessen bis hin zu einem Abtöten der Zellen. Die hemmende oder abtötende Wirkung von Bioziden ist abhängig vom eingesetzten Wirkstoff. Sie hängt zudem ab von der Art und der Lebensphase der Zielorganismen, den Umgebungsbedingungen sowie der Wirkstoffkonzentration.
Biozide können durch gleichzeitig anwesende Störstoffe deaktiviert werden. Unabhängig davon verbrauchen sich Biozide im Kontakt mit den Zielorganismen, d. h. die Wirkung ist zeitlich limitiert, da das Biozid verbraucht wird.
Biozide werden nach ihrem Zielort und ihren Angriffsmechanismen unterschieden. So werden die aktiven Substanzen in oxidierende und nicht oxidierende Wirkstoffe eingeteilt [10].
1.3.1 Oxidierende Biozide
Oxidierende Biozide zeichnen sich durch eine schnelle Reaktion mit unterschiedlichen Verbindungen aus, wobei es sich hierbei um Mikroorganismen, andere organische Substanzen oder Metalle handeln kann. Das wird auch als unspezifische Wirkung bezeichnet. Dabei spielt es anscheinend keine Rolle, ob es sich um Bakterien, Algen oder Pilze handelt; diese Wirkung umfasst nahezu alle Mikroorganismen.
Der Wirkungsmechanismus beruht häufig auf der Freisetzung hochreaktiver sauerstoffhaltiger Moleküle, Ionen und Radikale, die auch als sogenannte reaktive Sauerstoffspezies (ROS) bezeichnet werden. Oxidierend wirken aber auch Substanzen, die über halogenierte Gruppen verfügen wie Brom- oder Chlorabspalter. In jedem Fall zersetzt sich das Biozid unmittelbar in der Reaktion. Nach der Reaktion/Wirkung steht das Biozid nicht mehr zur Verfügung – auch dann nicht, wenn es gar keinen Kontakt zu Mikroorganismen hatte.
Unter den oxidierenden Bioziden finden sich typische Wirkstoffe aus der Schimmelpilzbeseitigung wie
- Hypochlorit,
- Chlordioxid,
- Wasserstoffperoxid und andere Perverbindungen, z B. Peressigsäure,
- Ozon.
Chlorgas wirkt direkt auf die Zellen durch Oxidationsprozesse an der Zellmembran und weiter durch Anreicherung in der Zelle. In Wasser eingeleitet, reagiert Chlor mit Wasser zu hypochloriger Säure und wirkt antimikrobiell, wenn die nichtdissoziierte Säure vorliegt. Bildet sich im alkalischen Milieu bevorzugt das Hypochlorit-Anion, ist die Wirksamkeit deutlich eingeschränkt. Chlorabspaltende Wirkstoffe folgen demselben Wirkprinzip, jedoch mit verzögerter Freisetzung und folglich langer Einwirkzeit [10].
Chlordioxid hingegen ist ein relativ stabiles freies Radikal. Die elektrophil-aktive Wirkung beruht auf einer Übertragung eines ungepaarten Elektrons auf die DNS der Zielorganismen, die dabei zerstört wird und so den Zelltod auslöst [10].
Eines der gebräuchlichsten Biozide ist Wasserstoffperoxid (H2O2). Wasserstoffperoxid ist im Vergleich zu anderen Peroxiden ein schwaches Oxidationsmittel, die Wirkung ist am effektivsten im sauren Milieu. Wasserstoffperoxid neigt insbesondere im Alkalischen zur Disproportion in Wasser und Sauerstoff, wodurch es seine oxidative Wirkung ohne weitere Stabilisierung schnell verliert. Katalysiert man diese Disproportion im Sauren durch Metallionen (Fenton-Reaktion), entsteht das hochreaktive Hydroxylradikal OH•. Man geht davon aus, dass die biozide Wirkung allein vom Hydroxylradikal ausgeht, das Makromoleküle, DNS und Proteine angreift. Da Wasserstoffperoxid auch bei Stoffwechselprozessen innerhalb von Zellen entstehen kann, produzieren Mikroorganismen spezielle Enzyme (Katalasen, Peroxidasen), um Wasserstoffperoxid zu inaktivieren. Um diese Reparaturmechanismen überwinden zu können, sind hohe H2O2-Einsatzkonzentrationen von > 5 % notwendig. Bei geringeren Einsatzkonzentrationen kann durch die Zugabe von Fruchtsäuren eine Inhibierung der Katalase-Aktivität innerhalb der Zellen bewirkt werden [10].
Häufig wird auch Peressigsäure eingesetzt, die im Vergleich zum Wasserstoffperoxid eine deutlich bessere mikrobizide Wirksamkeit aufweist, denn in stabilisierten Lösungen stellt sich ein Gleichgewicht zwischen Peressigsäure, undissoziierter Essigsäure sowie Wasserstoffperoxid ein. Bei der Verwendung von Peressigsäure sollte ein pH-Wert von 4,5 nicht überschritten werden [10].
Ozon als triatomarer Sauerstoff ist ebenfalls ein starkes Oxidationsmittel mit unspezifischer Wirkung. Als instabiles Molekül kann Ozon nicht gelagert werden, seine Halbwertszeit beträgt nur wenige Sekunden. Daher muss Ozon direkt am Einsatzort unter Verwendung von Ozongeneratoren hergestellt werden. Ozon wird hauptsächlich in der Wasserbehandlung eingesetzt [10]; hier konnte eine gute Wirkung gegen Pilze festgestellt werden. In der Sanierung nach Brandschäden wird Ozon häufig zur Geruchsbeseitigung verwendet. Anwendungen zur Luftreinigung bei Schimmelpilzschäden sind beschrieben, jedoch wird aufgrund der gesundheitsgefährdenden Wirkungen und nicht erwiesener Wirksamkeiten davon abgeraten [11; 12; 4].
1.3.2 Nichtoxidierende Biozide
Im Gegensatz zu den oxidierenden sind die nichtoxidierenden Biozide in ihrer Wirksamkeit spezifisch, d. h. den einzelnen Wirkstoffen sind Grenzen in ihrer Wirkung und Schnelligkeit gesetzt. Sie entfalten ihre Wirkung langsam und zersetzen sich erst bei Reaktion mit dem Zielorganismus, sodass sie insbesondere eingesetzt werden, wenn eine Depotwirkung (z. B. konservierende Biozidbehandlung) erzeugt werden soll. Aus der selektiven Wirkung leiten sich spezifische Bezeichnungen wie bakterizid, fungizid oder algizid ab. Die Spezialisierung führt aber dazu, dass Wirkungslücken auftreten, d. h. es kann nur eine Wirkung auf bestimmte Organismengruppen oder -gattungen erzielt werden. In der Praxis wird dies durch die Kombination mehrerer Wirkstoffe ausgeglichen.
Auch in der Wirkstoffgruppe der nicht oxidierenden Biozide sind Wirkstoffe vertreten, die aus der Schimmelpilzbeseitigung bekannt sind, z. B.
- Aldehyde,
- Alkohole,
- oberflächenaktive Substanzen (Quats, Biguanide, Guanidine),
Die Wirkungsweise von Bioziden wird auch nach dem Angriffsort und dem Wirkmechanismus in elektrophil-aktiv und membranaktiv unterschieden [10].
Elektrophil-aktive Biozide verfügen in ihrer chemischen Struktur über eine elektronegative Gruppe, die mit nukleo-philen Bestandteilen innerhalb der Zelle reagieren, z. B. mit Amino-, Thiol- oder Amidgruppen von Enzymen und Proteinen. Im Ergebnis werden lebenswichtige Enzyme inaktiviert. Allerdings gelten diese Effekte als reversibel. Die Zellen können die Wirkung durch Bildung von Schutzproteinen und Enzymen abschwächen und Schäden reparieren. Damit ist die Wirkung zeitlich begrenzt. Zu den elektrophil-aktiven Substanzen zählen Aldehyde, Biozide mit aktivierten Halogenatomen und organometallische Verbindungen [10].
Membranaktive Biozide bilden zunächst eine Art Umhüllung der Zelle. Dieser Vorgang gilt als reversibel, insbesondere bei nicht letaler Dosierung und geringer Einwirkzeit. So kann die Belegung der Zelloberfläche z. B. durch Spülen wieder abgelöst werden. In einem weiteren Schritt kommt es zu einer Zerstörung der äußeren Zellmembran, bis schließlich die Cytoplasma-Membran erreicht wird. Dies ist der eigentliche Wirkort dieser Biozidklasse. Durch Reaktion mit Membranbausteinen (mit Phospholipiden, aber auch Enzymen oder auch Komplexierung von Metallionen in den Membranen) verliert die Cytoplasma-Membran ihre semipermeablen Eigenschaften, bis die Zellwand die Integrität der Zelle nicht mehr aufrechterhalten kann. Die Zellen gelten als letal, selbst wenn zu diesem Zeitpunkt noch Stoffwechselaktivität besteht [13]. Membranaktive Biozide sind Alkohole, Phenolderivate, Säuren, oberflächenaktive Substanzen und komplexierende Verbindungen [10].
Mitunter lassen sich die Wirkorte nicht so eindeutig abgrenzen. Metallorganische Verbindungen können sowohl elektrophil- wie auch membranaktiv sein, ebenso Isothiazolinone. Nicht oxidierende Substanzen, die ihre höchste Wirksamkeit gegen Bakterien entfalten, werden Bakterizide genannt. Algizide blockieren selektiv die Fotosynthese bei Algen. Fungizide wirken speziell gegen Pilze, wie z. B. die Azolfungizide, welche die bei Pilzen einzigartige Ergosterol-Synthese in der Zellmembran unterbinden und so zu einer Zerstörung der Zellmembran führen. Bei Fungiziden sind einige Besonderheiten zu beachten: So wirken nicht alle Mittel gleichsam gegen Schimmelpilze und holzzerstörende Pilze. Die fungizide Wirkung wird zudem im Allgemeinen als eine Wirkung gegen vitale Zellen beschrieben, sodass Fungizide die Zellen der Hyphen angreifen. Dauerstadien wie Sporen werden hingegen nicht abgetötet, da die Sporen eine deutlich höhere Zellwandstärke zeigen und zudem nicht stoffwechselaktiv sind. Keimen Sporen jedoch aus, sind sie für eine fungizide Wirkung zugänglich. Sollen Sporen direkt inaktiviert werden, muss dies ausdrücklich für das zu verwendende Produkt beschrieben sein, z. B. durch den Zusatz „sporizid“ oder „wirkt auch gegen Pilzsporen“.
Alkohole zählen zu den membranaktiven Substanzen. Ihre Wirkung auf Membranen wird damit erklärt, dass wichtige Proteine, welche die Austauschprozesse und Stofftransporte in der Zellmembran regeln, denaturiert werden, nachdem die Alkohole durch die Membran adsorbiert wurden. Alkohole wirken nicht gegen Sporen, ihre Wirkung ist auf lebende Zellen beschränkt. Reine Alkohole wirken dabei ausschließlich dehydrierend, die Wirkung bleibt hinter entsprechenden wässrigen Lösungen zurück [10]. Niedere Alkohole sind besonders wirksam bei 50 bis 70 % Verdünnung. Besonders effektiv ist 60- bis 70%iges Ethanol, 50%iges Isopropanol verfügt über eine bessere Wirksamkeit als Ethanol. Darüber hinaus gilt auch hier, was bereits zu den primären Alkoholen ausgeführt wurde.
Beliebt sind auch quaternäre Ammoniumverbindungen (Quats). Quats haben eine Wirkungslücke gegen Pseudomonas im Speziellen sowie eine generell herabgesetzte Wirkung gegen Gramnegative und Mykobakterien. Dabei geht man davon aus, dass sich die Quats zunächst an die Zellen anheften, es aber anschließend zu einer Agglomeration der Zellen kommt, sodass die Zellen im Inneren der Zellaggregate vor dem Biozidkontakt geschützt sind. Erschwerend kommt hinzu, dass Eisenionen zur Inaktivierung der Quats führen. Als besonders wirkungsvoll werden Verbindungen mit einer C14-Alkylkette insbesondere gegen Pilze beschrieben. Sie sollten in einem pH-Bereich zwischen 3 und 9 eingesetzt werden. Als weitere Gruppe oberflächenaktiver Substanzen stehen Guanidine und Biguanide zur Verfügung. In ihrem Wirkungsspektrum sind diese den Quats durchaus gleichgestellt, sie gelten aber als etwas langsamer und benötigen teilweise höhere Einsatzkonzentrationen. Die bekanntesten Biguanide sind Chlorhexidin und Polyhexanid, die überwiegend in hygienischen/medizinischen Produkten eingesetzt werden. Im Gegensatz zu den Quats zeigen sie keine Wirkungslücke bei den Pseudomonaden. Empfohlen wird hierbei ein pH-Wert von 5 bis 7. Allen oberflächenaktiven Stoffen ist gemein, dass sie auf Oberflächen, wie z. B. Fußbodenbelägen, „aufziehen“, d. h. einen dünnen Film bilden, der auch nach einem Reinigungsvorgang noch vorhanden ist. Dies wäre bei den jeweiligen Anwendungen zu berücksichtigen. Zu beachten ist ebenfalls, dass oberflächenaktive Substanzen zu unerwünschten Wechselwirkungen mit Kunststoffen führen können.
1.4 Wirksamkeit von Bioziden zur Beseitigung von Schimmel
Eine Desinfektion ist per Definition eine Maßnahme, bei der Krankheitserreger so weit abgetötet werden, dass von ihnen keine Infektionsgefahren mehr ausgehen können. Entsprechende Desinfektionsmaßnahmen sind somit in Krankenhäusern und im Zusammenhang mit kontagiösen Krankheitserregern, zu denen die Schimmelpilze nicht zählen, sehr wichtig. In solchen Fällen sind Produkte anzuwenden, die nachweislich die auftretenden Krankheitserreger ausreichend, d. h. mindestens um fünf logarithmische Stufen, reduzieren. Entsprechend auf ihre Wirksamkeit für den jeweiligen Anwendungsfall geprüfte Desinfektionsmittel finden sich in der Liste des Verbandes für Angewandte Hygiene (VAH) [14] sowie in der Liste des Robert Koch-Instituts (RKI) [15], die für den Seuchenfall anzuwenden ist.
Soll die Wirksamkeit von Bioziden für die Schimmelpilzbekämpfung gemäß der ECHA-Richtlinie [9] nachgewiesen werden, muss nicht nur die Wirksamkeit der aktiven Substanzen belegt werden, sondern auch die Effizienz des Produkts unter typischen Anwendungsbedingungen. Getestet wird jedoch meist an definierten, aber in Bezug auf Schimmelpilzschäden vollkommen praxisfernen Systemen im Labor. Im Wesentlichen beruhen dabei alle Testverfahren, z. B. nach [16], auf einer Prüfung der Wirkstoffe gegen eine Sporensuspension. Im Anwendungsfall eines Schimmelschadens wird dieser damit aber nur sehr begrenzt widergespiegelt. Abgedeckt wären hierbei lediglich Anwendungen mit präventivem Charakter, z. B. um eine nicht befallene Wand vor auskeimenden Sporen zu schützen oder aber um nach der Feinreinigung verbliebene Sporen zu inaktivieren.
Die ECHA verweist hier zu Recht auf die in der Stufe 3 notwendigen Praxistests, die unter anderem auch das Behandeln betroffener Wände und Räume etc. vorsehen. Es gibt jedoch nur wenige Arbeiten zur Wirkung von Bioziden bei Schimmelpilzbefall unter praxisnahen Bedingungen, wobei diese teilweise methodische Einschränkungen und Defizite bei der statistischen Aussagekraft aufweisen. Dennoch zeigen die Ergebnisse dieser Studien nahezu einheitlich, dass unter praxisnahen Bedingungen keine oder keine nachhaltige Wirkung der Biozidbehandlung auf das Schimmelpilzwachstum in Innenräumen erreicht werden kann [17 bis 19]. Eine Entfernung der abgetöteten Biomasse, von der in gleicher Weise wie von den aktiv wachsenden Schimmelpilzen Gesundheitseffekte ausgehen können [4], kann durch Biozidanwendungen grundsätzlich nicht erreicht werden.
Die Studien zeigen zudem, dass Biozide wie H2O2, NaOCl, Peressigsäure, Isopropylalkohol oder quartäre Ammoniumverbindungen zwar kurzfristig Schimmelpilze inhibieren, aber die lebensfähigen Zellen nicht vollständig eliminieren können, sodass von entsprechenden Mitteln keine langfristige Verhinderung von Schimmelpilzwachstum erzielt werden kann [17 bis 19]. Die Ursachen hierfür sind systemimmanent. Erfolgt eine Biozidanwendung gegen etablierte Schimmelbefälle, so muss die aktive Substanz nicht etwa ein Auskeimen der Sporen verhindern, sondern gegen vitale und differenzierte Zellverbände wirken und auch deren Abwehrstrategien überwinden. Die meisten Schimmelpilze bilden Ruhestadien, wenn sie diesen Mitteln ausgesetzt werden. Sobald sich die Wachstumsbedingungen wieder verbessern, weil eine Verdünnung oder Entfernung der eingesetzten Substanzen stattfindet und/oder die Feuchtigkeit wieder zunimmt, keimen die Pilze erneut aus, sodass sich oft schon nach wenigen Tagen kein Unterschied zur Situation vor der Fungizidanwendung feststellen lässt. Zudem sind Zellzahl und -dichte in Myzelien im Vergleich zu einzelnen Sporen deutlich höher, sodass die bei den Produktprüfungen eingesetzten Konzentrationen und die Wirkzeiten in der Regel nicht ausreichen, um eine ausreichende Wirkung in der Praxis zu erzielen.
Im Gegensatz zu den in den Prüfungen verwendeten chemisch inerten und hochglatten OP-Fliesen kommt es beim Kontakt mit porösen und alkalischen Baustoffen zu inhibierenden Wechselwirkungen. Viele Biozide entfalten ihre optimale Wirkung im sauren Milieu und zerfallen sehr schnell beim Kontakt mit alkalischen Medien (z. B. Wasserstoffperoxid, Peressigsäure) [10; 20]. Dies reduziert die verfügbare Wirkstoffmenge ebenso wie eine Adsorption im Porenraum der Baustoffe. Im Endeffekt können diese Mittel nur kurzfristig eine Überführung der Schimmelpilze in Ruhestadien, in denen sie dann eventuell auch für kurze Zeit nicht kultivierbar sind, bewirken. Die Zellen, die sich in den Poren von rauen Materialien befinden, werden hingegen durch die Mittel gar nicht erreicht [18; 19].
Zudem besteht auch die Möglichkeit, dass Feuchte-/Schimmelschäden durch die Behandlung mit Bioziden nachteilig beeinflusst werden, da bei diesen Behandlungen üblicherweise große Wassermengen zusätzlich ins Baumaterial eingebracht werden müssen [17]. Beobachtet wurde zudem, dass robuste Gattungen eine Biozidbehandlung besser überstehen und danach das Befallsbild dominieren [20].
2 Negative Folgen durch den Einsatz von Bioziden zur Schimmelpilzbekämpfung
2.1 Direkte Gesundheitsgefährdungen durch Biozidanwendungen – Arbeitsschutzanforderungen
Von den bei Schimmelpilzschäden zum Einsatz kommenden Bioziden gehen teilweise erhebliche Gesundheitsgefährdungen für die Beschäftigten aus. So können Einatmen oder Hautkontakt Gesundheitsschäden verursachen. Einige der Wirkstoffe sind als leicht entzündbar eingestuft. Daher sind bei der Verwendung der Produkte besondere Arbeitsschutzmaßnahmen zu treffen.
Zunächst stellt sich jedoch die Frage, ob der Einsatz von Bioziden bei der Schimmelpilzsanierung aus Sicht des Arbeitsschutzes erforderlich ist. Wesentliche Gefährdung der Beschäftigten beim Entfernen schimmelpilzbelasteter Materialien ist eine mögliche sensibilisierende Wirkung durch das Einatmen von Sporen oder Myzel, was auch für das Einatmen von nicht lebensfähigen oder biozid behandelten Schimmelpilzbestandteilen gilt. Das Infektionsrisiko ist bei den Sanierungsarbeiten von nachrangiger Bedeutung. Eine Biozidanwendung vor Beginn der Sanierung hat daher keinen Einfluss auf die Zuordnung der Tätigkeiten zu den Gefährdungsklassen gemäß DGUV Information 201-028 [16].
Bei Fäkalschäden kann eine Biozidbehandlung von Oberflächen vor der Durchführung der Sanierungsmaßnahmen allerdings sinnvoll sein, um die Beschäftigten vor Infektionen durch Fäkalkeime zu schützen [21].
Die Verwendung von Bioziden ist mit zusätzlichen Gefährdungen verbunden. Dies ist bei der Gefährdungsbeurteilung zu berücksichtigen. Dabei ist zunächst zu prüfen, ob der Einsatz von Bioziden durch andere Maßnahmen ersetzt werden kann (Substitutionsgebot gemäß Gefahrstoffverordnung [22]). Anstelle einer Oberflächendesinfektion vor dem Entfernen befallener Materialien wird das Absaugen der Oberflächen mit einem Industriestaubsauger der Staubklasse H oder die Feuchtreinigung empfohlen. Zur Reduzierung der Biostoffe in der Luft können Luftreinigungsgeräte mit H-Filter eingesetzt werden. Wird auf eine mögliche Substitution verzichtet, ist dies im Rahmen der Gefährdungsbeurteilung zu begründen [16].
Auch aus Sicht des Arbeitsschutzes wird eindeutig festgestellt, dass es mit einer Biozidanwendung nicht möglich ist, vorhandene Biomasse vollständig zu entfernen oder neues Schimmelpilzwachstum nachhaltig zu verhindern, und dass bisher kein Verfahren bekannt ist, mit dem dies erreicht werden kann. Daher ist eine Biozidbehandlung zur Beseitigung der Schadensursache und des Schimmelpilzbefalls nicht geeignet [20].
Eine Biozidbehandlung nach einer Schimmelpilzsanierung ist ebensowenig notwendig. Eine Ausnahme stellt die anschließende Nutzung durch besonders gefährdete Personen dar. Dies sind Personen, die in ihrem Lebensumfeld generell auf geringe Keimlasten achten müssen, wie z. B. Patienten mit Krebserkrankungen, Transplantierte, Chemotherapie- oder HIV-Patienten. Es dürfen dann nur solche Biozide verwendet werden, die für die vorhandenen Oberflächen geeignet sind [3].
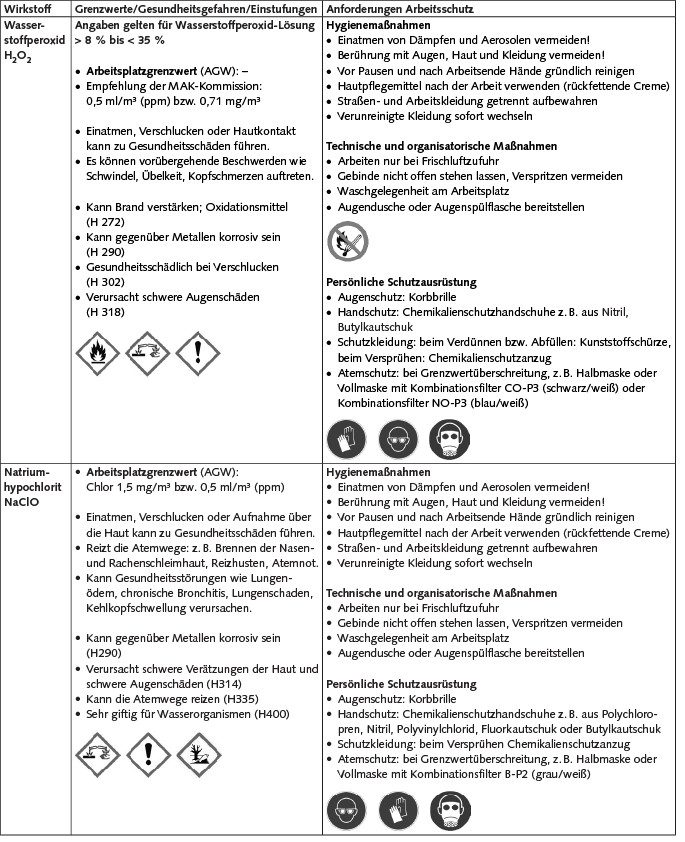
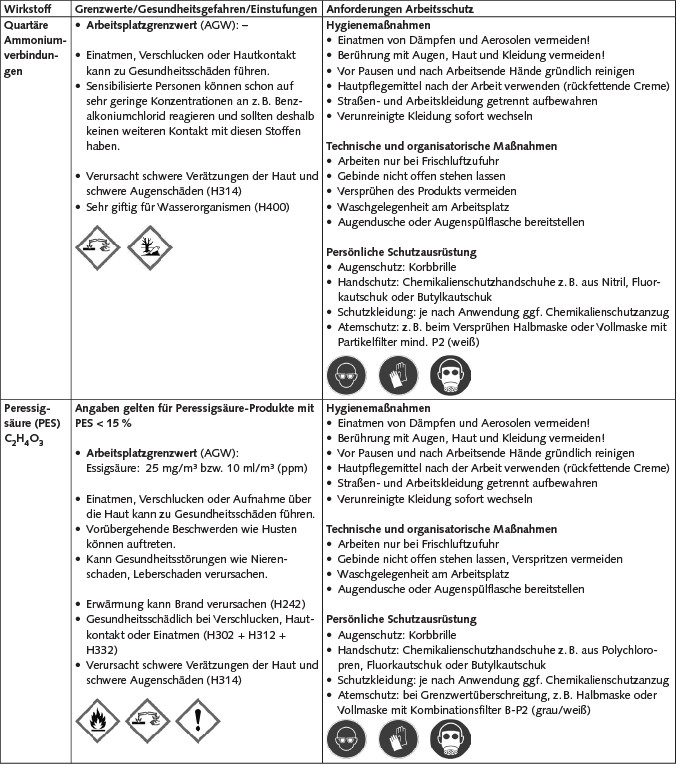
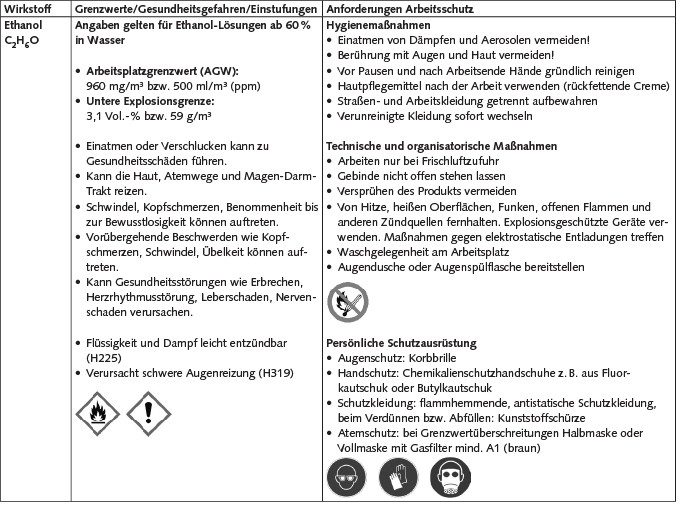
In der Tabelle sind für ausgewählte Wirkstoffe, die sich häufig in Biozidprodukten, die explizit zur Behandlung von Schimmelpilzschäden vermarktet werden, befinden, die erforderlichen Arbeitsschutzmaßnahmen beschrieben.
Für die Einstufung und Kennzeichnung der Produkte nach CLP-Verordnung [5] sind spezifische Konzentrationsgrenzwerte zu beachten. Nähere Informationen zu konkreten Biozidprodukten sind dem jeweiligen Sicherheitsdatenblatt zu entnehmen.
Bei den aufgeführten Wirkstoffen handelt es sich um Gefahrstoffe. Für Tätigkeiten mit diesen Stoffen gilt die Gefahrstoffverordnung [22]. Als Voraussetzungen für einen sicheren Umgang mit diesen Stoffen sind gemäß Gefahrstoffverordnung
- die Gefährdungen zu ermitteln und zu beurteilen,
- Schutzmaßnahmen festzulegen; dabei gilt die Rangfolge STOP (Substitution, Technische, Organisatorische, Per sönliche Maßnahmen),
- eine Betriebsanweisung zu erstellen und die Beschäftigten zu unterweisen,
- die arbeitsmedizinische Vorsorge zu gewährleisten.
Wirkstoffe wie auch Biozidprodukte (gebrauchsfertige Formulierungen) müssen nach Biozid-Verordnung [5] für die vorgegebene Verwendung zugelassen sein. Dies gilt auch für Verfahren, bei denen ein Biozid vor Ort hergestellt wird, z. B. Hypochlorit durch elektrochemisch-aktiviertes Wasser oder die Generierung von Ozon.
2.2 Unerwünschte Biozidwechselwirkungen
Wie zuvor ausgeführt, sind insbesondere oxidierende Biozide in ihren Angriffsmechanismen unspezifisch und nicht nur auf Mikroorganismen beschränkt. Sie reagieren mit allen organischen Substanzen am Einsatzort. Dies kann zu unerwünschten Wechselwirkungen führen. Die dabei entstehenden Reaktionsprodukte können schädigende Wirkung auf Anwender und Bewohner haben, sodass eine genauere Betrachtung dieser Wechselwirkungen notwendig ist.
Es ist bekannt, dass aus ungesättigten organischen Verbindungen durch Reaktionen mit starken Oxidationsmitteln wie z. B. Ozon oder dem Nitratradikal [23 bis 25], aber auch durch Autoxodation [26] Aldehyde, Ketone, Carbonsäuren sowie sekundäre Aerosole gebildet werden. Verantwortlich für die sekundäre Bildung dieser flüchtigen und kondensierten schwerflüchtigen Reaktionsprodukte im Innenraum sind ungesättigte Fettsäureester oder Polymere an Oberflächen, aber auch Küchen- und Haushaltsprodukte (Öle, Seifen, terpenhaltige Luftverbesserer) sowie die Raumnutzer selbst (Squalen und ungesättigte Fettsäuren der Haut [25]). Bei diesen Reaktionen entstehen reaktive Sauerstoffspezies (ROS) als entscheidende Zwischenprodukte (vor allem Hydroxylradikale), was die Vielzahl der entstehenden Reaktionsprodukte erklärt [23; 12]. Neben den homogenen Reaktionen in der Gasphase haben die an den Oberflächen der Innenräume ablaufenden heterogenen Reaktionen eine hohe Relevanz, weil nur durch sie die hohen Konzentrationen der gebildeten Produkte entstehen können [25; 22; 12].
Für die durch Reaktion mit Ozon im Innenraum entstehenden Oxidationsprodukte ist bekannt, dass kanzerogene Stoffe und irritativ wirkende Substanzen enthalten sein können [27; 28]. Ergebnisse von Wolkoff et al. [28] zeigen, dass zusätzlich zu den bekannten stabilen Oxidationsprodukten (Aldehyde, Ketone und Säuren) weitere, weitaus stärkere Irritanzien entstehen. Allerdings sind die gesundheitlichen Einflüsse infolge der in Innenräumen ablaufenden Oxidationsprozesse schwer zu ermitteln, weil die entstehenden ROS oft kurzlebig und schwer zu analysieren und die Reaktionsprodukte somit noch weitgehend unbekannt sind [25; 12]. Eine inhalative Exposition gegenüber den hoch oxidierten Produkten mit Hydroperoxid- und Peroxid-Gruppen wird dadurch, dass sie sich an bestehende Partikel anlagern oder zu neuen Partikeln kondensieren können und sich dadurch eine Aufkonzentrierung ergibt, als besonders problematisch angesehen [5]. Einen potenziell negativen Einfluss auf die Innenraumluftqualität haben solche Reaktionsprodukte auch aufgrund ihrer oft niedrigen Geruchsschwellen [12].
Zur Behandlung von Schimmelpilzschäden werden häufig Natriumhypochlorit (NaOCl) sowie Wasserstoffperoxid (H2O2) [29], das zusammen mit unterschiedlichen Katalysatoren und Stabilisatoren zum Einsatz kommt, verwendet. Die Oxidationsstärke des NaOCl ergibt sich durch die Freisetzung von hypochloriger Säure bzw. freiem Chlor, wobei in Folgereaktionen auch sauerstoffhaltige Radikale entstehen können. H2O2 setzt insbesondere im Sauren Hydroxylradikale frei. Bei der Anwesenheit bestimmter Übergangsmetallsalze kann je nach Wertigkeit der Metallionen die Ausbeute an Hydroxylradikalen dramatisch erhöht werden. Dabei kommen sowohl produktspezifische Stabilisatoren wie Silber, aber auch umgebungsbedingt vorhandene Metalle wie Kupfer oder Eisen infrage. Man weiß, dass die Entstehung dieser reaktiven Sauerstoffverbindungen die Voraussetzung dafür darstellt, dass eine große Anzahl von Oxidationsprodukten mit hohen Reaktionsgeschwindigkeiten gebildet wird. Die bei der Verwendung der betrachteten Biozide resultierenden Produktausbeuten werden folglich ebenfalls davon abhängen, ob – sekundär außerhalb der mikrobiziden Wirkung – Hydroxylradikale unter den gegebenen Randbedingungen entstehen oder nicht. Auch wenn die Oxidationsprozesse der Innenraumluft noch weitgehend unverstanden sind, so wird doch davon ausgegangen, das H2O2 unter bestimmten Bedingungen als Oxidationsmittel eine Rolle im Innenraum spielen kann [25].
Während sehr intensiv über gesundheitliche Effekte der sekundären Reaktionsprodukte des Spurengases Ozon mit Bestandteilen aus Hölzern und Holzwerkstoffen, den zur Oberflächenbehandlung oder beim Kochen eingesetzten Ölen oder mit terpenhaltigen Reinigungs- und Haushaltsprodukten diskutiert wird, sind uns keine Studien über die entsprechenden Reaktionsprodukte infolge der ROS-Bildung nach H2O2– oder NaOCl-Einsatz bekannt. Dies ist umso erstaunlicher, wenn große Mengen an Bioziden, die zur Schimmelpilzsanierung oft großflächig auf organische Materialien aufgebracht werden, betrachtet werden. Insofern kann nicht abgeschätzt werden, ob aufgrund einer Exposition gegenüber solchen Oxidationsprodukten eine Gesundheitsgefahr für die Beschäftigten, die mit diesen Bioziden in Innenräumen arbeiten, oder für die Gebäudenutzer, die sich im Anschluss an die Sanierung in den Räumlichkeiten aufhalten, besteht.
Bekannt ist hingegen, dass NaOCl mit vielen Stoffen reagiert und dabei gefährliche Gase freisetzen kann. Zusammen mit Salzsäure entsteht beispielsweise giftiges Chlorgas, mit Ammoniak bilden sich explosive Gemische. Aber auch Produkte auf H2O2-Basis sind aufgrund ihres oxidativen Potenzials gefährlich, da sie bei Kontakt mit Augen und Haut durch die an den Oberflächen stattfindenden Reaktionen zu starken Schädigungen führen können. Entsprechende Produkte sollten deshalb eigentlich für den Normalverbraucher und für Anwendungen im Innenraum nicht ohne weitere Sicherungsmaßnahmen zugelassen werden.
2.3 Auswirkungen auf die Mykotoxinproduktion
Neben den chemischen Reaktionen führt der Einsatz von Bioziden häufig auch dazu, dass die überlebenden Schimmelpilze mit Änderungen ihrer Wachstumsstrategie, ihres Metabolismus oder ihrer Mykotoxinproduktion reagieren. So ist für viele chemische, biologische und physikalische Einflussfaktoren schon lange bekannt, dass sie sich auf die Mykotoxin-Biosynthese bestimmter Pilze auswirken [29 bis 31]. Für einzelne Fungizide wurde bereits gezeigt, dass sie eine verstärkte Mykotoxinproduktion der Pilze provozieren [32].
In Laborexperimenten konnte inzwischen zudem nachgewiesen werden, dass reaktive Sauerstoffspezies und die daraus entstehenden Produkte [17; 33 bis 35]) sowie auch explizit die Zugabe von H2O2 [36] zu toxigenen Aspergillus-Isolaten die Aflatoxinsynthese steigern. Auch die biochemischen Mechanismen und Regulationsprozesse, die der Korrelation zwischen ROS-Konzentration und Aflatoxinsynthese zugrunde liegen, werden teilweise schon verstanden [6; 37 bis 39]). Zur Erklärung des Zusammenhangs wird vermutet, dass eine erhöhte Aflatoxinproduktion und die damit verbundenen Mechanismen einen Wachstumsvorteil unter trockenen und heißen Umweltbedingungen, die mit hohen ROS-Konzentrationen einhergehen, gegenüber anderen Mikroorganismen darstellen [38; 40 bis 42]).
Peitzsch et al. [19] untersuchten die Auswirkung mehrerer Fungizide, unter denen auch H2O2– und NaOCl-haltige Mittel waren, auf die Mykotoxinproduktion von Stachybotris chartarum und Aspergillus versicolor, die sie direkt auf Baumaterialien zum Wachstum gebracht hatten. Während für die meisten der verwendeten Mittel eine Konzentrationszunahme der von Stachybotris chartarum produzierten Satratoxine G und H erfolgte, die auch in dieser Studie als Stressreaktion interpretiert wurde, blieben die Konzentrationen des von Aspergillus versicolor produzierten Sterigmatocystins weitgehend konstant.
Auch die Trichothecen- [17; 43; 44] und die Fumonisinproduktion [45] von Fusarien werden durch oxidativen Stress beeinflusst. So konnte für Fusarium graminearum eine positive Korrelation zwischen H2O2-Zugabe und Trichothecensynthese gezeigt werden [44]. In einer weiterer Studie dieser Arbeitsgruppe [43] ergaben sich bezüglich der Trichothecenproduktion von Fusarium graminearum und Fusarium culmorum jedoch chemotypabhängige Unterschiede, die mit Unterschieden der antioxidativen Abwehr, die sich in der Studie durch unterschiedliche Katalaseaktivitäten zeigten, einhergingen. Auch Ferrigo et al. [45] fanden in Laborexperimenten in Abhängigkeit vom jeweiligen Stamm für Fusarium verticillioides teilweise eine Abnahme und teilweise eine Zunahme der Fumonisinproduktion nach H2O2-Zugabe. Sie konnten nachweisen, dass diese Variationen bei den Regulationsprozessen der Fumonisinsynthese mit der jeweiligen Genexpression der Stämme korrelieren. Bei diesen Experimenten zeigte sich zudem, dass keine Korrelation zwischen der Fumonisinproduktion und dem anhand der Biomasse quantifizierten Pilzwachstum der unterschiedlichen Stämme nach der Zugabe von H2O2 bestand.
Zwar wird im Allgemeinen davon ausgegangen, dass unter typischen Innenraumbedingungen die biologischen Wirkschwellen für die inhalative Exposition nicht erreicht werden [29; 46 bis 48], allerdings sind kaum belastbare Daten zu den potenziell in der Raumluft vorkommenden Mykotoxinen verfügbar [46; 49]. Zudem wäre es aus hygienischen Gründen bzw. aus präventivmedizinischer Sicht nicht tolerierbar, wenn sich infolge des Einsatzes von Bioziden zu Sanierungszwecken eine Zunahme der Konzentrationen dieser teilweise sehr potenten Giftstoffe [50; 51] ergäbe. Auch dieser eventuell für die Innenraumluftqualität sehr relevante Aspekt einer Erhöhung der Mykotoxinkonzentrationen infolge von Biozidanwendungen ist bisher nicht weiter untersucht worden.
Literatur
- Leitfaden zur Ursachensuche und Sanierung bei Schimmelpilzwachstum in Innenräumen („Schimmelpilzsanierungs-Leitfaden“). Hrsg.: Umweltbundesamt. Berlin, 2005.
- Schimmelbefall in der Wohnung. Presseinformation Nr. 26. Hrsg.: Umweltbundesamt. Berlin, 2009.
- Leitfaden zur Vorbeugung, Erfassung und Sanierung von Schimmelbefall in Gebäuden („Schimmelleitfaden“). Hrsg.: Umweltbundesamt. Dessau/Roßlau, 2017 (in Druck).
- Wiesmüller, G. A.; Heinzow, B.; Aurbach, U.; Bergmann, K.-C.; Bufe, A.; Buzina, W.; Cornely, O. A.; Engelhart, S.; Fischer, G.; Gabrio, T.; Heinz, W.; Herr, C. E. W.;, Kleine- Tebbe, J.; Klimek, L.; Köberle, M.; Lichtnecker, H.; Lob- Corzilius, T.; Merget, R.; Mülleneisen, N.; Nowak, D.; Rabe, U.; Raulf, M.; Seidl, H. P.; Steiß, J. O.; Szewszyk, R.; Thomas, P.; Valtanen, K.; Hurraß, J.: AWMF-Schimmelpilz-Leitlinie „Medizinisch klinische Diagnostik bei Schimmelpilzexposition in Innenräumen”. AWMF 2016, AWMF-Register-Nr. 161/001.
- Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen, zur Änderung und Aufhebung der Richtlinien 67/548/EWG und 1999/45/EG und zur Änderung der Verordnung (EG) Nr. 1907/2006 (genannt CLP-Verordnung (Classification, Labelling and Packaging)). ABl. EG (2008) Nr. L 353, S. 1-1355.
- Richtlinie 98/8/EG des Europäischen Parlaments und des Rates vom 16. Februar 1998 über das Inverkehrbringen von Biozid-Produkten. ABl. EG (1998) Nr. L 123, S.1-63
- Verordnung über die Meldung von Biozid-Produkten nach dem Chemikaliengesetz (Biozid-Meldeverordnung – ChemBiozidMeldeV) vom 14. Juni 2011. BGBl. I, S. 1-1085.
- Gesetz zum Schutz vor gefährlichen Stoffen (Chemikaliengesetz – ChemG). In der Fassung der Bekanntmachung vom 28. August 2013. BGBl. I, S. 3498, 3991. Zul. geänd. durch Art. 4, Abs. 97 des Gesetzes vom 18. Juli 2016. BGBl. I, S. 1666.
- Guidance on the biocidal products regulation, Volume II Efficacy – assessment and evaluation (Parts B+C). ECHA-17-G-03-EN. Hrsg.: European Chemicals Agency (ECHA). Helsinki, Finnland 2017.
- Paulus, W.: Directory of microbicides for the protection of materials. A Handbook. Springer. New York, 2005.
- Hubbard, H. F.; Coleman, B. K.; Sarwar, G.; Corsi, R. L.: Effects of an ozone-generating air purifier on indoor secondary particles in three residential dwellings. Indoor Air 15 (2005), S. 432-444.
- Waring, M. S.; Siegel, J. A.: The effect of an ion generator on indoor air quality in a residential room. Indoor Air 21 (2010), S. 267-276.
- Veldhuis, M. J. W.; Kraay, G. W.; Timmermans, K. R.: Cell death in phytoplancton: correlation between changes in membrane permeability, photosynthetic activity, pigmentation and growth. Eur. J. Phycol. 36 (2001) S. 167-177.
- Desinfektionsmittel-Liste des Verbundes für Angewandte Hygiene (VAH) e.V. Wiesbaden: mhp 2017.
- Liste der vom Robert Koch-Institut geprüften und anerkannten Desinfektionsmittel und -verfahren. Hrsg.: Robert Koch-Institut (RKI). Bundesgesundheitsbl. 56 (2013), S. 1702-1705.
- DGUV Information 201-028. Handlungsanleitung – Gesundheitsgefährdungen durch biologische Arbeitsstoffe bei der Gebäudesanierung. Hrsg.: Deutsche Gesetzliche Unfallversicherung (DGUV). Berlin, 2006.
- Betz, S.: Biozidbehandlung als Alternative zum Rückbau? B+B 40 (2017), S. 72-75.
- Chakravarty, P.; Kovar B.: Evaluation of five antifungal agents used in remediation practices against six common indoor fungal species. J. Occup. Environ. Hyg. 10 (2013), S. 11-16.
- Peitzsch, M.; Bloom E.; Haase, R.; Must, A.; Larsson L.: Remediation of mould damaged building materials – efficiency of a broad spectrum of treatments. J. Environ. Monit. 14 (2012), S. 908-915.
- Messal, C.: Desinfektion von Schimmelpilzbefällen – Wo stehen wir? Der Bausachverständige 6 (2013), S. 33-36.
- Informationsblatt zur Beurteilung und Sanierung von Fäkalschäden im Hochbau. Hrsg.: Berufsverband Deutscher Baubiologen VDB e.V. Jesteburg, 2010.
- Verordnung zum Schutz vor Gefahrstoffen (Gefahrstoffverordnung – GefStoffV). Vom 26. November 2010. BGBl. I, S. 1643.
- Chen, X.; Hopke, P. K.: Secondary organic aerosol from pinene ozonolysis in dynamic chamber system. Indoor Air 19 (2009), S. 335-345.
- Fan, Z.; Lioy, P.; Weschler, C.; Fiedler, N.; Kipen, H.; Zhang, J.: Ozone-initiated reactions with mixtures of volatile organic compounds under simulated indoor conditions. Environ. Sci. Technol. 37 (2003), S. 1811-1821.
- Gligorovski, S.; Weschler, J.: The oxidative capacity of indoor atmospheres. Environ. Sci. Technol. 47 (2013), S. 3905-3906.
- Makowski, M; Ohlmeyer, M.; Meier, D.: Long-term development of VOC emissions from OSB after hot-pressing. Holzforschung 59 (2005), S. 519-523.
- Weschler, C. J.: Ozone‘s impact on public health: Contribu- tions from indoor exposures to ozone and products of ozone-initiated chemistry. Environ. Health Perspect. 114 (2006), S. 1489-1496.
- Wolkoff, P.; Clausen, G.; Wilkins, C. K.; Nielsen, G. D.: Formation of strong airway irritants in terpene/ozone mixtures. Indoor Air 10 (2000), S. 82-91.
- Koburger, T.; Below, H.; Dornquast, T.; Kramer, A.: Decontamination of room air and adjoining wall surfaces by nebulizing hydrogen peroxide. G.M.S. Krankenhaushygiene Interdisziplinär 6 (2011), S. 1-10.
- Klich, M. A.: Environmental and developmental factors influencing aflatoxin production by Aspergillus flavus and Aspergillus parasiticus. Mycoscience 48 (2007), S. 71-80.
- Ribeiro, J. M.; Cavaglieri, L. R.; Fraga, M. E.; Direito, G. M.; Dalcero, A. M.; Rosa, C. A.: Influence of water activity, temperature and time on mycotoxins production on barley rootlets. Lett. Appl. Microbiol. 42 (2006), S. 179-184.
- Gareis, M.; Ceynowa, J.: Einfluß des Fungizids Matador (Tebuconazol/Triadimenol) auf die Mykotoxinbildung durch Fusarium culmorum. Lebensm. Unters. Forsch. 198 (1994), S. 244-248.
- Gao, X.; Kolomiets, M. V.: Host-derived lipids and oxylipins are crucial signals in modulating mycotoxin production by fungi. Toxin Rev. 28 (2009), S. 79-88.
- Jayashree, T.; Subramanyam, C.: Oxidative stress as a prerequisite for aflatoxin production by Aspergillus parasiticus. Free Rad. Biol. Med. 29 (2000), S. 981-985.
- Reverberi, M.; Punelli, M.; Smith, C. A.; Zjalic, S.; Scarpari, M.; Scala, V.; Cardinali, G.; Aspite, N.; Pinzari, F.; Payne, G. A.: How peroxisomes affect aflatoxin biosynthesis in Aspergillus flavus. PLoS ONE 7 (2012), S. e48097.
- Fountain, J. C.; Khera, P.; Yang, L.; Nayak, S. N.; Scully, B. T.; Lee, R. D.; Chen, Z. Y.; Kemerait, R. C.; Varshney, R. K.; Guo, B. Z.: Resistance to Aspergillus flavus in maize and peanut: Molecular biology, breeding, environmental stress, and future perspectives. Crop J. 3 (2015), S. 229-237.
- Reverberi, M.; Zjalic, S.; Ricelli, A.; Punelli, F.; Camera, E.; Fabbri, C.; Picardo, M.; Fanelli, C.; Fabbri, A. A.: Modulation of antioxidant defense in Aspergillus parasiticus is involved in aflatoxin biosynthesis: A role for the ApyapA gene. Eukaryotic Cell (2008), S. 988-1000.
- Roze, L. V.; Hong, S. Y.; Linz, J. E.: Aflatoxin biosynthesis: Current frontiers. Ann. Rev. Food Sci. Technol. 4 (2013), S. 293-311.
- Grintzalis, K., Vernardis, S. I.; Klapa, M. I.; Georgiou, C. D.: Role of oxidative stress in sclerotial differentiation and aflatoxin B1 biosynthesis in Aspergillus flavus. Appl. Environ. Microbiol. 80 (2014), S. 5561-5571.
- Fountain, J. C.; Scully, B. T.; Chen, Z. Y.; Gold, S. E.; Glenn, A. E.; Abbas, H. K.; Lee, R. D.; Kemerait, R. C.; Guo, B.: Effects of hydrogen peroxide on different toxigenic and atoxigenic isolates of Aspergillus flavus. Toxins 7 (2015), S. 2985-2999.
- Fountain, J. C.; Scully, B.T.; Ni, X.; Kemerait, R. C.; Lee, R. D.; Chen, Z. Y.; Guo, B. Z.: Environmental influences on maize-Aspergillus flavus interactions and aflatoxin production. Front. Microbiol. 5 (2014), S. 1-7.
- Narasaiah, K. V.; Sashidhar, R. B.; Subramanyam, C.: Biochemical analysis of oxidative stress in the production of aflatoxin and its precursor intermediates. Mycopathologia 162 (2006), S. 179-189.
- Ponts, N.; Couedelo, L.; Pinson-Gadais, L.; Verdal-Bonnin, M. N.; Barreau, C.; Richard-Forget, F.: Fusarium response to oxidative stress by H2O2 is trichothecene chemotype-dependent. FEMS Microbiol. Lett. 293 (2009), S. 255-262.
- Ponts, N.; Pinson-Gadais, L.; Verdal-Bonnin, M. N.; Barreau, C.; Richard-Forget, F.: Accumulation of deoxynivalenol and its 15-acetylated form is significantly modulated by oxidative stress in liquid cultures of Fusarium graminearum. FEMS Microbiol. Lett. 258 (2006), S. 102-107.
- Ferrigo, D.; Raiola, A.; Bogialli, S.; Bortolini, C.; Tapparo, A.; Causin, R.: In vitro production of fumonisins by Fusarium verticillioides under oxidative stress induced by H2O2. J. Agric. Food Chem. (2015), S. 4879-4885
- Bedeutung von Mykotoxinen im Rahmen der arbeitsplatzbezogenen Gefährdungsbeurteilung. Sachstandsbericht. Hrsg.: Ausschuss für Biologische Arbeitsstoffe (ABAS). Dortmund, 2007.
- Fischer, G.; Dott, W.: Relevance of airborne fungi and their secondary metabolites for environmental, occupational and indoor hygiene. Arch. Microbiol. 179 (2003), S. 75-82.
- Kelman, B. J.; Robbins, C. A.; Swenson, L. J.; Hardin, B. D.: Risk from inhaled mycotoxins in indoor office and residential environments. Int. J. Toxicol. 23 (2004), S. 3-10.
- Gottschalk, C.; Bauer, J.; Meyer, K.: Detection of satratoxin G and H in indoor air from a water-damaged building. Mycopathologia 166 (2008),103-107.
- Bennett, J. W.; Klich, M.: Mycotoxins. Clin. Microbiol. Rev. 16 (2003), S. 497-516.
- Nielsen, K. F.: Mycotoxin production by indoor molds. Fungal Genet. Biol. 39 (2003), S. 103-117.
Dr. Julia Hurraß - Gesundheitsamt der Stadt Köln, Abteilung Infektions- und Umwelthygiene.
Constanze Messal - MICOR Gesellschaft für mikrobielle Prozesse und Materialkunde, Rostock
Andrea Bonner - Berufsgenossenschaft der Bauwirtschaft, Prävention, Bereich Sanierung und Bauwerksunterhalt, Karlsruhe.