Bestimmung der Endotoxinaktivität
Zusammenfassung Die Quantifizierung von Endotoxin anhand der Endotoxinaktivität ist vielfach von Bedeutung, u. a. im Rahmen der medizinischen Hygienekontrolle, für die Bioaerosolcharakterisierung und für Arbeitsplatzbeurteilungen. Obwohl der Limulus-Amöbozyten-Lysat-Test (LAL-Test) hierfür bereits in den 1970er-Jahren etabliert wurde, existiert kein international akzeptiertes Standardprotokoll. Insbesondere die Stärke des Einflusses von zugesetztem Detergens während der Extraktion ist bislang nicht quantifiziert. Die vorliegende Untersuchung beschreibt anhand von 102 Probenahmen mit elektrostatischen Passivsammlern (EDC) an Arbeitsplätzen und in Privathaushalten den Einfluss einer Detergentien-Zugabe (Tween-20) auf die Quantifizierung der Endotoxinaktivität. Die Ergebnisse der Extraktion mit und ohne Detergens korrelieren hoch signifikant (rs = 0,95; p < 0,0001). Der Einfluss von Tween-20 ist je nach Höhe der Endotoxinaktivität unterschiedlich: Im Niedrigkonzentrationsbereich (< 10 EU/ml) verdoppelt Tween die Extraktionsergebnisse, bei höherer Konzentration (≥ 10 EU/ml) verdreifacht es das Ergebnis gegenüber Detergens-freien Messwerten. Bereits mit einem einzigen Extraktionsschritt wird über 80 % der Endotoxinaktivität für die Quantifizierung zugänglich – unabhängig von der Verwendung von Tween-20.

Quelle: PantherMedia/Alex Federenko
1 Einleitung
Die Quantifizierung der Endotoxinaktivität ist sowohl in der medizinischen Forschung und der Hygienekontrolle als auch in der Arbeits- und Umweltmedizin von Bedeutung [1 bis 3]. Endotoxine sind integraler Bestandteil der Zellmembran von Gram-negativen Bakterien und stellen biochemisch Lipopolysaccharide (LPS) dar. Endotoxine sind ubiquitär verbreitet und weisen auf das Vorhandensein Gram-negativer Bakterien hin. Die Verwendung endotoxinfreier Materialien ist u. a. im medizinischen Bereich geboten, um Infektionsrisiken für den Patienten zu minimieren. In der Arbeits- und Umweltmedizin dient die Bestimmung von Endotoxinaktivitäten häufig zur Charakterisierung von Bioaerosolen. Die Exposition gegenüber Bioaerosolen gilt als möglicher Risikofaktor für die Entwicklung von Atemwegskrankheiten (zusammengefasst in [2]). Die komplexen Inhaltsstoffe von Bioaerosolen können toxisch, sensibilisierend, infektiös, irritativ, reizend oder belästigend wirken. Bisher gibt es noch keine Methode, die alle Bestandteile eines Bioaerosols gleichzeitig aufzeigt. Als Surrogat-Marker für mikrobielle Komponenten wird deshalb vielfach die Endotoxinaktivität erfasst, auch wenn dadurch keine Aussagen über Schimmelpilze, Gram-positive Bakterien oder andere mikrobielle Bestandteile getroffen werden können.
1.1 Grenzwertdiskussion
Obwohl der Umgang mit biologischen Arbeitsstoffen mit ihren zahlreichen, auch pathogenen, Komponenten an vielen Arbeitsplätzen notwendig ist, z. B. in der Landwirtschaft, bei der Abfallverwertung oder in der Nahrungsmittelindustrie, ist man sich der gesundheitsrelevanten Wirkung bewusst. Im Rahmen der Risikobetrachtung der inhalativen Wirkung von Endotoxinen an Arbeitsplätzen wurden bereits in den 1990er-Jahren gesundheitsbasierte Grenzwerte diskutiert. Das Dutch Expert Committee on Occupational Safety (DECOS) [4], ein Komitee des Niederländischen Gesundheitsrats, empfiehlt gesundheitsbasierte Expositionslimits am Arbeitsplatz. Diese Empfehlungen dienen als Basis für die gesetzlich vom Ministerium festgelegten Expositionslimits. Der zunächst vorgeschlagene gesundheitsbasierte Grenzwert von 50 EU/m³ und die in den Niederlanden geplante schrittweise Einführung des Grenzwertes beginnend mit 200 EU/m³ wurden nach einer Probephase wieder verworfen. Diese Empfehlung ging im Wesentlichen auf eine Untersuchung von Castellan et al. [5] zurück und berücksichtigte den No Observed Effect Level (NOEL) für akute Lungenfunktionsveränderungen. Derzeit wird ein gesundheitsbasiertes Expositionslimit (Health-Based Recommended Exposure Limit, HBROEL) für Endotoxin am Arbeitsplatz von 90 EU/m3 (8-Stunden gewichtetes Mittel) empfohlen [4]. Für Deutschland gibt es keine entsprechende Empfehlung. Nach dem Minimierungsgebot werden allerdings entsprechende Schutzmaßnahmen an Arbeitsplätzen empfohlen.
1.2 Bestimmung der Endotoxinaktivität – Unterschiedliche methodische Empfehlungen
International etabliert zur Endotoxinbestimmung im Umwelt- und Arbeitsbereich ist der Limulus-Amöbozyten-Lysat-Test (LAL-Test). Es handelt sich um ein biologisches Testsystem: Die Hämolymphe des Pfeilschwanzkrebses (auch Molukken- oder Hufeisenkrebs genannt) gerinnt beim Kontakt mit Endotoxin, das sich dadurch quantitativ nachweisen lässt. Nicht standardisiert ist die genaue Durchführung des Tests. Für alle Messungen und die Beurteilung der Messergebnisse gilt, dass das methodische Vorgehen – angefangen von der Staubsammlung über die Extraktion bis hin zur Durchführung des LAL-Tests – einbezogen werden muss, da es sich nachweislich auf die Ergebnisse auswirkt. Das DECOS verweist diesbezüglich auf die NEN-EN 14031 (Deutsche Fassung EN 13098) [6], die allerdings viele Details der Methode offen lässt, vor allem hinsichtlich der Extraktion. Weiterhin wird eine Publikation von Spaan et al. [7] als Orientierung benannt, in der für die bei der aktiven Staubsammlung beaufschlagten Glasfaserfilter eine einstündige Extraktion unter Zusatz von 0,05 % Tween-20 empfohlen wird.
Im Bereich des deutschen Arbeitsschutzes wurde der chromogen-kinetische Limulustest 1997 durch die Kennzahl 9450 der IFA-Arbeitsmappe [8] als standardisierte Methode allgemein eingeführt und ein Verzicht auf die Verwendung von Detergens empfohlen, da der Einfluss von Tween-20 auf das Messergebnis nicht abschätzbar war. Zum Zeitpunkt der Empfehlungen fand die Probensammlung vornehmlich aktiv unter Verwendung von Glasfaser- oder Teflonfiltern oder via Luft-Impaktion auf Agarplatten statt. Die – vor allem für epidemiologische Studien entwickelte – Passivsammlung hat erst seit 2010 zunehmend an Bedeutung gewonnen [9 bis 11].
Die Extraktion von Filtern nach aktiver Staubsammlung wird bisher sowohl mit Tween [7; 12; 13] als auch ohne Tween [3; 14; 15] durchgeführt. Gleiches gilt für die Extraktion nach Passivsammlung, die je nach Fragestellung sowohl mit [16] als auch ohne Tween-Zusatz erfolgt [10].
Entsprechend der Empfehlung von Spaan et al. [7] wird als Detergens üblicherweise 0,05 % Tween-20 verwendet, Normand et al. [16] arbeitet mit 0,1 % Tween-80. Sowohl Tween-20 als auch Tween-80 sind Monoester mit 20 Polyoxyethyleneinheiten, Tween- 80 enthält jedoch Ölsäure statt Laurinsäure. Beide Tween-Varianten sind Polysorbate, die als Lösungsvermittler, Emulgatoren und Stabilisatoren Verwendung finden.
Grundsätzlich kann das Detergens Tween zur Extraktion aus allen gängigen Sammlermaterialien (Teflonfilter, Glasfaserfilter, elektrostatische Tücher) eingesetzt werden. Vor allem, um Allergene nachzuweisen, erweist sich der Zusatz von Tween-20 als vorteilhaft [9; 17; 18]. Im Hinblick auf die Endotoxinaktivität wurde allerdings bereits in verschiedenen Arbeiten gezeigt, dass Tween-20 im Rahmen der Extraktion die Nominalwerte der Endotoxinaktivität signifikant modifiziert [1; 19].
Aufgrund unterschiedlicher Messprotokolle sind vergleichende methodische Betrachtungen elementar. Einige Arbeitsgruppen haben deshalb bereits den Einfluss methodischer Parameter auf die Bestimmung der Endotoxinaktivität nach luftgetragener Probenahme untersucht. Übereinstimmend zeigte sich dabei, dass die Verwendung von Tween-20 bei der Extraktion den größten Einfluss auf das Messergebnis hat [1; 19; 20]. Weiterhin spielen das Extraktionsvolumen, die Lagerung der Proben (Bestimmung der Endotoxinaktivität in frischen oder vorübergehend eingefrorenen Extrakten) und das LAL-Reagenz des jeweiligen Anbieters eine bedeutende Rolle für das Ergebnis [1; 7].
In der vorliegenden Arbeit wurde die Staubprobensammlung mittels elektrostatischer Staubtücher (Electrostatic Dust fall Collectors, EDCs) durchgeführt und der Einfluss von Tween-20 (0,05 %) auf die Extraktion untersucht (schematische Darstellung des Versuchsaufbaus siehe Bild 1).
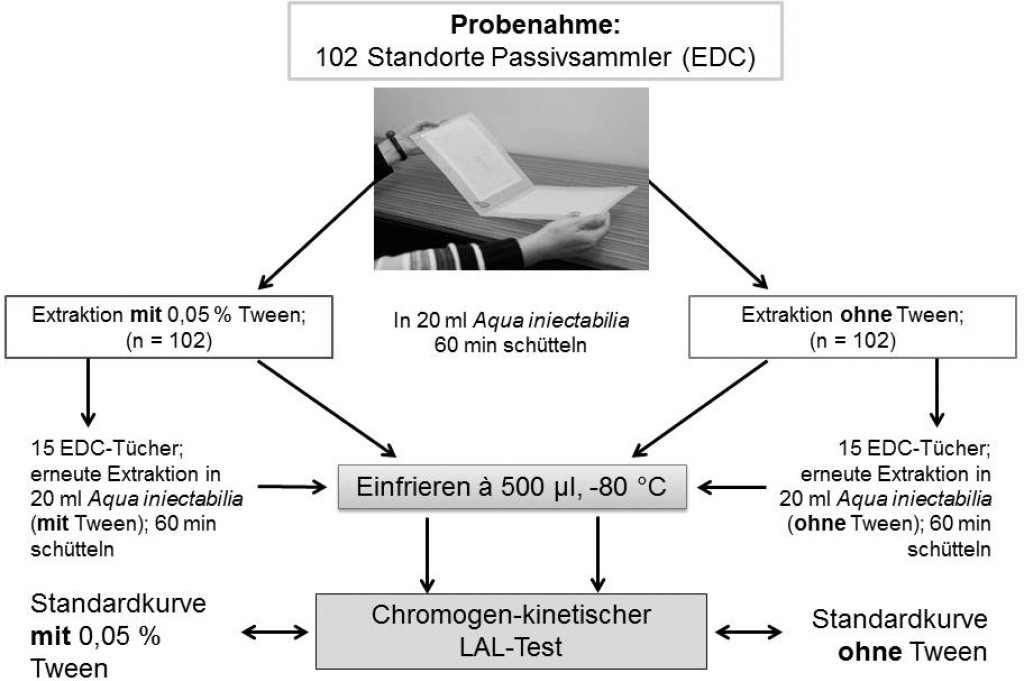
Bild 1. Schematische Darstellung der Probenverarbeitung anhand von Passivsammlern (Electrostatic dust fall collectors = EDC). An 102 Probenahmeorten wurden jeweils zwei Staubtücher für 14 Tage zur Passivsammlung ausgelegt. Für die Bestimmung der Endotoxinaktivität erfolgte die Extraktion nach einem standardisierten Protokoll, einmal mit und einmal ohne Zusatz von 0,05 % Tween-20. 15 Sammler wurden einer zweiten Extraktion unterzogen.
Foto: IFA/IPA
Die Sammlung mit EDCs ist besonders für umfangreiche epidemiologische Studien geeignet, da u. a. keine besonderen technischen Kenntnisse oder Vorrichtungen für die Probensammlung erforderlich sind. Bei dem zur Passivstaubsammlung eingesetztem Equipment handelt es sich um zwei bzw. vier elektrostatische Staubtücher (EDC), die in der Regel über 14 Tage am Messort ausgelegt wurden. Zweifach- oder Vierfachsammler ermöglichen es, parallel beaufschlagtes Probenmaterial für jeweils unterschiedliche Analysen einzusetzen. Für die Bestimmung von (Innenraum-)Allergenen, Glucanen und Endotoxinen konnte dieses Equipment bereits erfolgreich verwendet werden [9; 11; 17; 18; 21; 22]. Sander et al. empfehlen für die Extraktion von Allergenen (Hausstaubmilbe, Katze, Hund, Maus) aus den EDCs die Verwendung von Phosphatpuffer und Tween-20 [18]. Dass die Sammlung mittels EDC ebenso zuverlässige und reproduzierbare Daten wie die Luftsammlung kultivierbarer Mikroorganismen liefert, haben Normand et al. bereits 2009 mit Pferdestallstaub nachgewiesen [23].
Ziel der vorliegenden Untersuchung war es zu klären, inwieweit die Endotoxinaktivität von Passivsammler-Extrakten, die mit und ohne Tween-20 gewonnen wurden, korreliert und ggf. durch einen definierten Faktor in Beziehung steht. Des Weiteren wurde anhand einer zweiten Extraktion überprüft, ob die Endotoxinaktivität mittels Detergens vollständiger aus den Staubtüchern extrahiert werden kann.
Die Ergebnisse sollen dazu beitragen, die im Rahmen der Passivstaubsammlung gewonnenen Werte zur Endotoxinaktivität und ihrer Einflussfaktoren zu analysieren und damit die Beurteilung der Messungen zu verbessern.
2 Material und Methoden
2.1 Staubsammlung
Die Staubsammlung erfolgte mithilfe einer passiven Sammelmethode: Elektrostatische Staubtücher, die zuvor für vier Stunden auf 200 °C erhitzt worden waren, wurden in 1,5 bis 2 m Höhe für 14 Tage an Arbeitsplätzen und in Privathaushalten ausgelegt [9; 10; 11; 13].
Dadurch wurde nur der Staub gesammelt, der sich durch elektrostatische Kräfte und ohne aktive Staubsammlung (z. B. mittels Pumpe) auf den Sammlern absetzt. An einem Sammelort lagen jeweils zwei staubbindende Tücher, die in einer Plastikmappe befestigt waren (Bild 1). Die Tücher wurden vor der Benutzung autoklaviert. Die Sammelfläche je Staubtuch beträgt 0,032 m2. Die Mappen wurden nach Ablauf der Sammelzeit in Umschläge gelegt und bei Raumtemperatur zum Labor geschickt. Die staubbindenden Tücher wurden dort unter einer sterilen Werkbank mit abgeflammter Pinzette in autoklavierte 150-ml-Borosilikat-Bechergläser überführt, mit autoklavierter Alufolie abgedeckt und bis zur Extraktion bei +4 °C im Kühlschrank aufbewahrt.
2.2 Extraktion der Staubsammler
Zur Extraktion wurden die Tücher mit 20 ml Aqua iniectabilia (Allemanpharma, Rimbach, Deutschland) bedeckt, 60 min auf einem Horizontalschüttler (140 Shakes/min) geschüttelt und der Überstand in pyrogenfreie 50-ml-Plastikröhrchen (Falcon, VWR, Darmstadt, Deutschland) pipettiert. Anschließend wurde ein Teil à 1 000 μl bei -80 °C bis zur Messung eingefroren. Mit der Pipettenspitze wurde dabei das Tuch jeweils so gut wie möglich ausgedrückt, um die eingesetzte Flüssigkeit zurückzugewinnen.
Die Extraktion mit Tween-20 verlief identisch, aber unter Zugabe von 0,05 % Tween-20 (Serva, Heidelberg, Deutschland, Nr. 37470, Lot.100541; 20 ml Aqua inicetabilia + 10 μl Tween-20). Für die zweite Extraktion wurde das jeweilige Tuch nach der ersten Extraktion erneut mit 20 ml Aqua iniectabilia geschüttelt und der Überstand gewonnen.
2.3 Bestimmung der Endotoxinaktivität
Der Nachweis der Endotoxinaktivität erfolgte mit dem chromogen-kinetischen LAL-Test (Charles River, Sulzfeld, Deutschland). Das Endotoxin-Lyophylisat für die Standardkurve wurde jeweils entweder in Aqua iniectabilia oder Aqua iniectabilia + 0,05 % Tween-20 gelöst. Entsprechend wurde die Probenverdünnung mit Aqua oder Aqua + 0,05 % Tween-20 durchgeführt.
Alle Proben wurden in Doppelbestimmung eingesetzt und 1 : 10, 1 : 100 oder 1 : 1000 verdünnt. Zusätzlich wurden zu jeder Probe zwei Kontrollwerte mitgeführt, jeweils mit 5 EU/ml Endotoxin versetzte Messproben (Spike). Die Wiederfindungsrate (Recovery) des eingesetzten Endotoxins wurde in Prozent gemessen. Proben mit einer Recovery unter 50 oder über 200 % wurden in einer anderen Verdünnung wiederholt oder anderenfalls verworfen.
2.4 Statistik
Die Daten wurden mittels Median, 10-%- und 90-%-Perzentilen, Mittelwert und Streuung beschrieben. Der monotone Zusammenhang zwischen den Variablen wurde mittels Spearman-Rangkorrelation (rs) berechnet. Ein p-Wert von p < 0,05 galt als signifikant. Signifikanzen wurden mit dem nicht parametrischen Wilcoxon-Mann-Whitney-Test bestimmt. Die Berechnungen wurden mit GraphPad Prism (GraphPad Software Inc., San Diego, Kalifornien, USA) sowie SAS 9.4 durchgeführt. Einfache lineare Regressionsfaktoren wurden nach logarithmischer Transformation für die Wertegruppe < 10 EU/ml und ≥ 10 EU/ml getrennt bestimmt. Falls zwei Extraktionen durchgeführt wurden, galt die Summe der Endotoxinaktivität aus erster und zweiter Extraktion als 100 %.
3 Ergebnisse
3.1 Einfluss von Tween-20 auf die Endotoxin-Standardreihe
Die Standardkurve zur Bestimmung der Endotoxinaktivität umfasst neben dem Nullwert fünf definierte Konzentrationen: 0,001; 0,005; 0,5; 5 und 50 EU/ml. Insgesamt zwölf Standardkurven mit bzw. ohne Zugabe von Tween-20 (0,05 %) wurden miteinander verglichen. Die Zeit bis zum Farbumschlag unterscheidet sich für alle fünf Endotoxinaktivitäten signifikant zwischen den Proben mit und ohne Tween (p < 0,0001, Wilcoxon-Mann-Whitney-Test; Bild 2).
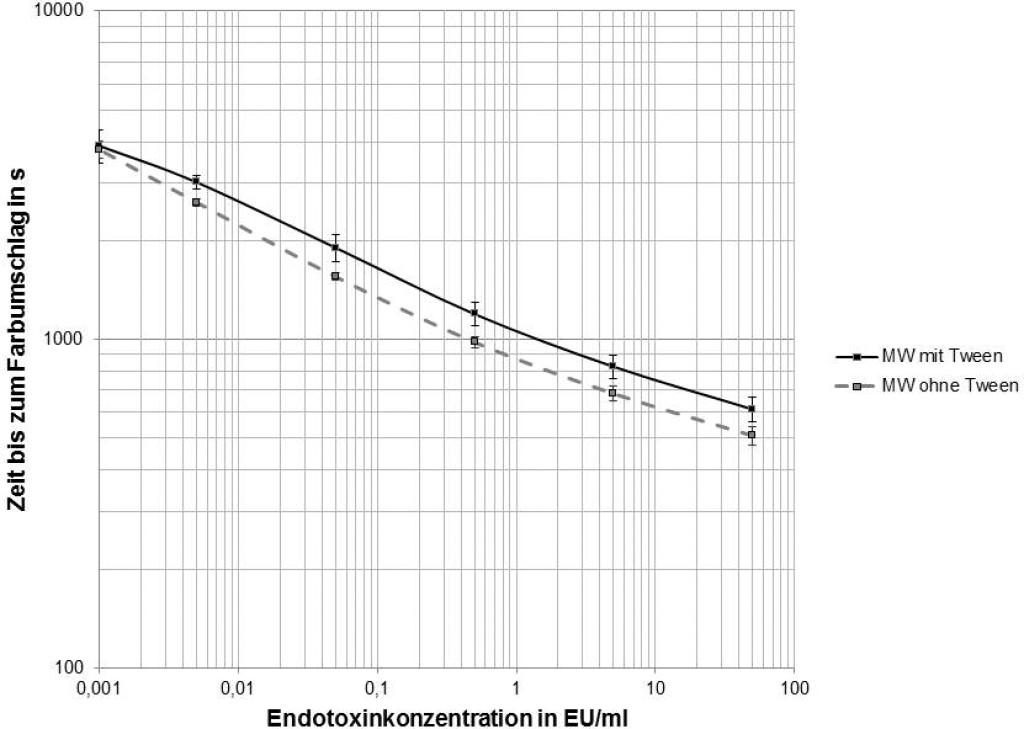
Bild 2. Standardkurven des LAL-Tests. Der Mittelwert (Zeit bis zum Farbumschlag) und Standardabweichung von jeweils zwölf Standardkurven mit und ohne Zusatz von Tween-20 ist dargestellt. Es besteht ein signifikanter Unterschied (zweiseitiger Wilcoxon-Rang-Test) im Vergleich von Tween-haltigen zu Tween-freien Proben.
Foto: IFA/IPA
Unter dem Einfluss von Tween-20 kommt es zu einem signifikant langsameren Farbumschlag (p < 0,0001), was wiederum bedeutet, dass höhere Endotoxinaktivitäten generiert werden. Für den Nullwert (Aqua inictabilia ohne Endotoxin) wurde kein signifikanter Unterschied infolge von Tween-20 festgestellt (Median: 3 822 s ohne Tween; 3 897 s mit Tween, p = 0,665).
3.2 Einfluss von Tween-20 auf die nachgewiesene Endotoxinaktivität
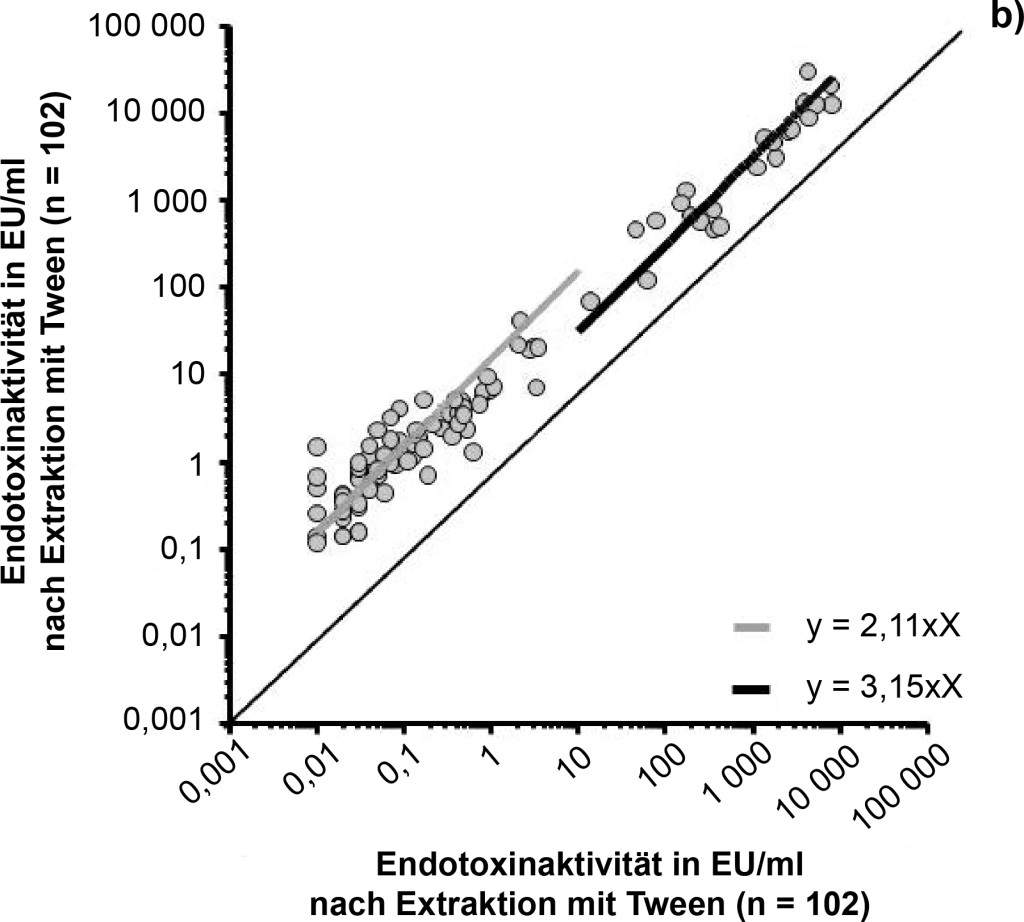
Insgesamt wurde an 102 verschiedenen Orten ein Passivsammler mit jeweils zwei Staubtüchern ausgelegt. Eines der Tücher wurde mit Zusatz von Tween-20 (0,05 %), das andere ohne Tween-20 extrahiert. In allen 204 Proben ließ sich Endotoxinaktivität nachweisen, wobei die Werte zwischen 0,02 und 8 020 EU/ml für die Tuchextrakte, die ohne Tween-20 erhalten wurden, lagen. Höhere Endotoxinaktivitäten wiesen die parallel gewonnenen Extrakte mit Tween-20 auf (0,16 bis 29 764 EU/ml). Der Unterschied zwischen den Extrakten mit Tween-20 und den Extrakten ohne Tween-20 war signifikant (p < 0,0001, Wilcoxon-Rang Test; Bild 3a).
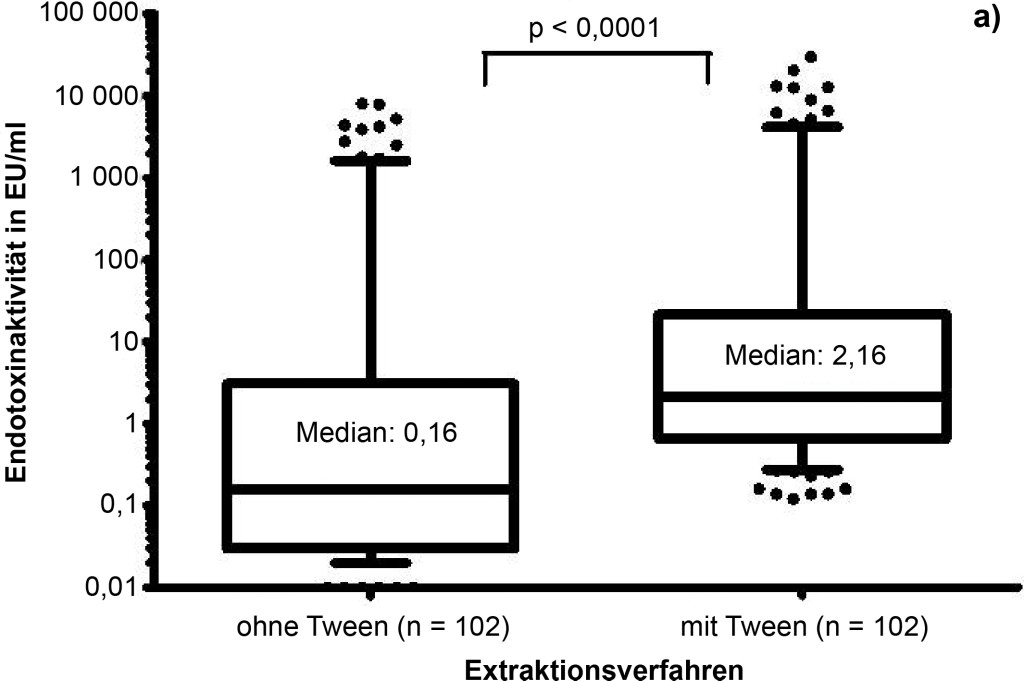
Bild 3. a) Einfluss des Extraktionsverfahrens (mit bzw. ohne Tween-20) auf die Endotoxinaktivität. Die nachweisbare Endotoxinaktivität von Staubtüchern (dargestellt Median und 10- und 90-%-Perzentile), die nach Extraktion mit Tween gemessen wurde, ist signifikant (p < 0,0001) höher als nach Extraktion ohne Tween (paariger T-Test; n = 102). b) Korrelation der Endotoxinaktivitäten nach Extraktion mit und ohne Tween-20 und Ermittlung von Regressionsfaktoren. Die im LAL-Test nachgewiesene Endotoxinaktivität aus Staubtuch-Extrakten mit Tween-20 korreliert hoch signifikant mit der ohne Tween-20 (rs = 0,95; p < 0,0001). Der Regressionsfaktor für die Wertegruppe < 10 EU/ml beträgt 2,11 und für die Wertegruppe ≥ 10 EU/ml 3,15.
Foto: IFA/IPA
Die Ergebnisse der beiden Extraktionsverfahren sind hoch signifikant miteinander korreliert (rs = 0,95; p < 0,0001; Bild 3b). Die Ergebnisse mit Tween-20 waren im Einzelfall 1,2- bis 150-fach höher gegenüber den Messwerten ohne Detergens. Das Verhältnis der mit Tween gewonnenen Ergebnissen zu denen, die ohne Tween gewonnen wurden, lag im Median bei 13,0 für die Werte < 10 EU/ml (n = 79) und bei 2,5 für die Werte ≥ 10 EU/ml. Die lineare Regression nach logarithmischer Transformation ergab für die Wertegruppe < 10 EU/ml (n = 79) eine Steigung von 2,1 (95-%-Konfidenzintervall 1,94 bis 2,29) und für die Wertegruppe ≥ 10 EU/ml (n = 23) eine Steigung von 3,1 (95-%-Konfidenzintervall 3,0 bis 3,31).
3.3 Einfluss von Tween-20 auf die Recovery
Als Qualitätskontrolle wurde zu jeder Probe eine mit 5 EU/ml Endotoxin versetzte „Spike“-Probe mitgeführt. In den getesteten Proben lag die Recovery zwischen 64 und 156 %, unabhängig davon, ob mit oder ohne Tween extrahiert wurde (Median ohne Tween 112 % versus Median mit Tween 109 %; n = 102). Jede Probe wurde in Doppelbestimmung durchgeführt. Die Variationsbreite der Doppelbestimmungen unterschied sich nicht signifikant zwischen den beiden Extraktionsverfahren (Median des Variationskoeffizienten: 5,7 % für beide Gruppen).
Alle mit Tween-20 versetzten Proben wurden auf eine mit Tween-20 versetzte Standardkurve bezogen, da anderenfalls die Recoverywerte unter 50 oder über 200 % lagen.
3.4 Extraktion der Staubtücher – Einfluss wiederholter Extraktion
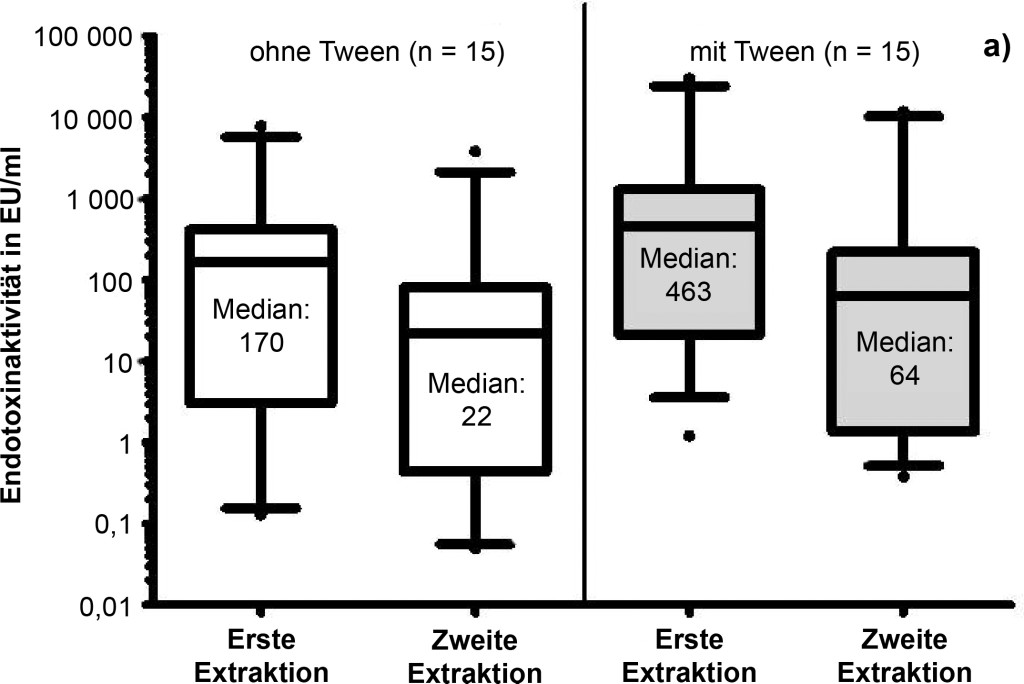
Aus 30 Staubtüchern wurde zweimal nacheinander ein Extrakt durch jeweils einstündiges Schütteln hergestellt. Für 15 dieser Staubtücher wurde ein Extraktionsprotokoll ohne Tween verwendet, für die anderen 15 ein Protokoll mit 0,05 % Tween-20.
In allen Extrakten war Endotoxinaktivität nachweisbar, unabhängig davon, ob Tween-20 zur Extraktion verwendet wurde oder nicht (Bild 4a).
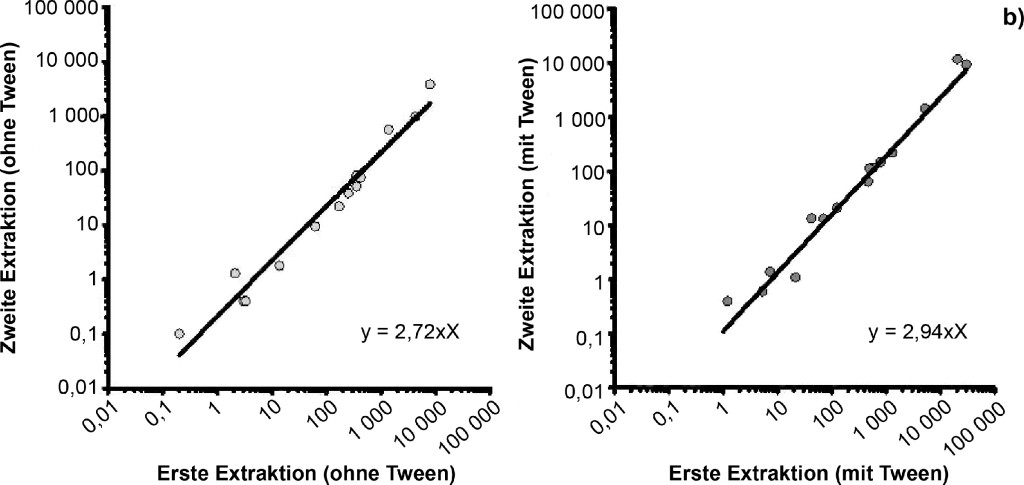
Bild 4. a) Einfluss von Tween-20 auf die Endotoxinaktivität bei einer wiederholten Extraktion. Jeweils 15 Staubtücher wurden ohne bzw. mit Zusatz von Tween-20 zweimal nacheinander für eine Stunde in Aqua iniectabilia geschüttelt. In allen Extrakten war Endotoxinaktivität nachweisbar. Es besteht kein signifikanter Unterschied zwischen der Extraktionseffizienz mit und ohne Tween-20. Im Median werden 85 % (bzw. 84 % mit Tween-20) der Endotoxinaktivität in der ersten Stunde aus dem Staubtuch extrahiert. b) Einfluss von Tween-20 auf die Endotoxinaktivität bei einer wiederholten Extraktion – Ermittlung eines Regressionsfaktors. Je höher die Endotoxinaktivität, die während einer einstündigen Extraktion aus den Filtertüchern (jeweils 15) eluiert wurde, desto höher war auch die Endotoxinaktivität, die noch im zweiten Extraktionsschritt im Überstand nachweisbar ist. Es besteht kein signifikanter Unterschied der Ergebnisse mit und ohne Tween-20 (Korrelation rs = 0,98 mit Tween, rs = 0,97 ohne Tween; p < 0,0001).
Foto: IFA/IPA
Betrachtet man die Summe der nach Extraktion 1 und 2 gewonnenen Werte als 100 % Endotoxinaktivität, werden durch den ersten Extraktionsschritt 63 bis 88 % der gesamten Endotoxinaktivität aus den Tüchern extrahiert, sofern Aqua iniectabilia verwendet wurde (n = 15). 64 bis 95 % der gesamten Endotoxinaktivität wurde bei der ersten Extraktion aus den Tüchern gewonnen, wenn Aqua iniectabilia + 0,05 % Tween-20 verwendet wurde (n = 15). Somit besteht kein signifikanter Unterschied zwischen der Extraktionseffizienz mit und ohne Tween-20. Im Median wurden 85 % (ohne Tween-20) bzw. 84 % (mit Tween-20) des Endotoxins in der ersten Extraktionsphase aus dem Staubtuch extrahiert.
Es besteht darüber hinaus eine hoch signifikante Korrelation zwischen der Höhe der Endotoxinaktivität im ersten und zweiten Waschschritt (rs = 0,98; mit Tween, rs = 0,97 ohne Tween; p < 0,0001). Je höher die Endotoxinaktivität, die sich nach dem ersten Waschen nachweisen lässt, desto höher ist sie auch noch nach dem zweiten Waschschritt. Dieser Effekt ist unabhängig von der Zugabe von Detergens (Bild 4b).
4 Diskussion
Um Endotoxine nachzuweisen, wird derzeit national und international überwiegend der indirekte Nachweis über die Endotoxinaktivität mittels LAL-Test verwendet. Dabei werden die Nominalwerte der Endotoxinaktivität einer Probe nicht nur von der eigentlichen Messung, sondern auch von der Staubsammlung und der Probenextraktion beeinflusst. Qualitätsgesicherte, standardisierte Probenahmen, Probenaufbereitungen und Messverfahren sind deshalb obligatorisch, um nationale und internationale Datenerhebungen zur Endotoxinexposition gemeinsam aus- und bewerten zu können und gegebenenfalls Expositionslimits abzuleiten [24]. Da es bisher keine verbindlichen Vorschriften für alle beteiligten Arbeitsschritte gibt, ist es notwendig, dass Anwender die Einflussgrößen möglichst genau kennen und diese auch dokumentieren.
In der vorliegenden Untersuchung wurden an 102 Messorten je zwei Staubtücher als Passivsammler für 14 Tage ausgelegt. Die Hälfte der Tücher wurde mit, die andere Hälfte ohne 0,05 % Tween-20 extrahiert. Da Zweifach-Passivsammler verwendet wurden, mussten die Tücher nicht geteilt werden, sondern für jede der beiden Analysen stand ein einzelnes Tuch vom selben Sammelplatz zur Verfügung. Auf diese Weise kann näherungsweise von einer gleichen Staubmenge bzw. -zusammensetzung auf den Tüchern einer Sammlung ausgegangen werden.
Es zeigte sich, dass die Zugabe von Tween-20 während der Probenaufbereitung zu höheren Endotoxinaktivitäten im Vergleich zu den Tween-freien Extrakten führte, wobei die Ergebnisse hoch signifikant miteinander korreliert waren (rs = 0,95; p < 0,0001). Diese höheren Nominalwerte beruhen vor allem auf einer direkten Beeinflussung des LAL-Tests und nicht auf der mittels Tween vermehrt aus den Sammlern gelösten Endotoxinaktivität. Anhand von zwölf Tests konnte gezeigt werden, dass die Standardkurven mit Tween-20 gegenüber solchen ohne Tween-20 signifikant höher ausfielen (d. h. verlangsamter Farbumschlag). Für die vorliegenden Staubsammlungen galt dabei ein Regressionsfaktor von 2 (für Werte < 10 EU/ml) bzw. 3 (für Werte ≥ 10 EU/ml) für die Relation der Werte mit und ohne Tween.
Anhand einer wiederholten Extraktion von 15 Staubtüchern konnte gezeigt werden, dass nach der ersten Extraktion (1 h) noch etwa 16 % (Median) der Endotoxinaktivtät auf den Staubtüchern verblieben – unabhängig davon, ob mit oder Tween-20 extrahiert wurde. Die nicht erfasste Menge an Endotoxinaktivität war dabei umso höher, je höher die Belegung des Staubtuchs mit Endotoxin war.
Der LAL-Test wurde erstmals von Fred Bang 1956 [25] beschrieben. Mit diesem Test werden Endotoxine indirekt über ihre Aktivität nachgewiesen; die Messergebnisse werden deshalb in Endotoxin-Einheiten (Endotoxin Units/ml, EU/ml) angegeben. Der LAL-Test ist ein enzymatischer Test, der an die physiologische Reaktion der Pfeilschwanzkrebs-Hämolymphe (Gelbildung) ein Nachweisverfahren gekoppelt hat. Infolgedessen kann die Endotoxinwirkung durch Trübung (turbidimetrischer Test) oder Färbung (chromogen) nachgewiesen werden.
National und international gilt der LAL-Test bisher als Nachweisverfahren der Wahl. Eine Entwicklung im Rahmen dieses Verfahrens, die sowohl den Tierschutz als auch die Standardisierung des biologischen Materials im Auge hat, stellt der rekombinante LAL-Test dar. Dafür wurde das Proenzym Faktor C, eine Serinprotease (132 kDa), rekombinant hergestellt. Der Faktor C initiiert die Reaktionskaskade, die zur Gelbildung führt. Eine signifikante Korrelation zwischen Ergebnissen des klassischen LAL-Tests und denen des rekombinanten Faktor-C-Tests konnte mehrfach nachgewiesen werden [26 bis 28]. Zu beachten ist, dass trotz hoher Korrelationen signifikante Unterschiede in den Absolutwerten vorliegen können.
McKenzie et al. [28] verweisen auf die große Bedeutung der Extraktionsverfahren für das Messergebnis der Endotoxinaktivität. Olenchock et al. [29] haben bereits 1989 nachgewiesen, dass der chromogene LAL-Test durch die Zugabe von Detergens modifiziert wird. Sie raten deshalb zu einer Endotoxinextraktion mit reinem Wasser. Auch in der IFA-Arbeitsmappe [8] wird die Aufbereitung von Luftfilterproben ohne Tween-20 empfohlen. Spaan et al. [19] beschreiben konkret, dass der Lipopolysaccharid-Standard im LAL-Test durch Tween gehemmt wird, was die Eichkurve nach oben verschiebt.
In unseren Tests bestätigte sich die Beobachtung, dass die Standardkurve mit Tween-20 höhere Werte aufweist als die ohne Detergens (verlangsamter Farbumschlag und damit höhere Nominalwerte der Endotoxinaktivität). Die Verwendung von Tween-20 hat also weniger den Effekt, vorhandenes Endotoxin besser aus den Staubtüchern zu lösen. Vielmehr greift es durch die Standard-Bezugskurve direkt in den Test ein, wodurch höhere Messwerte kalkuliert werden als ohne Detergens. Dass Tween-20 nicht in erster Linie ein besseres Herauslösen vorhandenen Endotoxins ermöglicht, wird durch das vorliegende Experiment der wiederholten Extraktion erhärtet: Nach einer Stunde Extraktion sind zwar die Nominalwerte der Endotoxinaktivität in den Proben mit Tween-20 höher, es verbleibt aber prozentual gesehen genauso viel Endotoxinaktivität auf den Sammlern wie bei Tween-freier Behandlung (ca. 16 %). Der Erfolg der Extraktion war somit weniger vom Detergens als mehr von der Belegung des Sammlers abhängig. Befand sich viel Endotoxin auf dem Sammler, wurden auch in einem zweiten Waschschritt noch höhere Mengen an Endotoxinaktivtät nachgewiesen. Es bleibt zu vermuten, dass sich auch mit einem dritten Waschschritt noch Endotoxinaktivität nachweisen ließe, ein sinnvolles „Kosten-Nutzen“-Verhältnis ist aber offenkundig bereits nach dem ersten Auswaschen gegeben.
Spaan et al. [19] schlugen vor, die zu untersuchenden Proben mindestens 50-fach zu verdünnen, da der Tween-Effekt für die stärker verdünnten Proben weniger ins Gewicht fiel. Allerdings würde das bedeuten, dass auf diese Weise ein Test-immanenter Fehler (Einfluss von Tween) mit einer weiteren Fehlerquelle (Verdünnungsfehler) kombiniert wird. In den hier dargestellten Proben kam bei 92 (ohne Tween) respektive 90 (mit Tween) der 102 Proben ein Verdünnungsfaktor von 1 : 10 zum Einsatz, die weiteren zehn bzw. zwölf Proben mussten 1 : 100 oder 1 : 1000 verdünnt werden.
Spaan et al. [19] ermittelten in Luftstaubproben aus diversen Quellen (Abwasser, Schweinestall, Haushalt, Kartoffelfabrik, Getreide) eine durchschnittliche Relation von fünf- bis zehnfach zwischen der Endotoxinaktivität aus Extrakten mit und ohne Tween. In der hier vorgestellten Studie ergab sich für die Staubproben, die mittels Passivsammlung auf elektrostatischen Staubtüchern gesammelt wurden, ein Verhältnis von 13-fach (Median für Endotoxinwerte < 10 EU/ml) bzw. 2,5-fach (Median für Endotoxinwerte ≥ 10 EU/ml) zwischen Tween-haltigen und Tween-freien Proben. Die Relation von Tween-haltigen zu Tween-freien Proben ist also in Abhängigkeit von der Endotoxinkonzentration unterschiedlich und sollte deshalb immer differenziert betrachtet werden. Der Regressionsfaktor lag in unseren Untersuchungen bei 2 (für Endotoxinwerte < 10 EU/ml) bzw. 3 (für Endotoxinwerte ≥ 10 EU/ml). Im Gegensatz zu der von Spaan et al. beschriebenen Tendenz, dass sich der Tween-Effekt in Proben mit geringerer Endotoxinkonzentration stärker auswirkt, konnten wir zeigen, dass der Tween-Effekt für Staubextrakte aus EDCs höher ausfällt, wenn die Endotoxinaktivität über 10 EU/ml liegt.
Noss et al. [13] zeigten für 60 Passivsammler, die für 14 Tage in Privathaushalten ausgelegt wurden, dass eine nachweisbare Konzentration oberhalb der Bestimmungsgrenze (limit of detection) nur mit Tween-20 möglich war. Die Bestimmungsgrenze war definiert als der Mittelwert der Leerwerte zuzüglich doppelter Standardabweichung. Diese Problematik trat in den vorliegenden Untersuchungen nicht auf. In allen Extrakten der Passivsammler war Endotoxinaktivität nachweisbar.
Zahlreiche weitere Studien im Bereich der Bioaerosolforschung wurden unter Verwendung von Tween-20 durchgeführt, unter anderem, weil das Detergens für die Allergenextraktion von Bedeutung ist [18; 30]. Epidemiologische Studien gewinnen zunehmend an Bedeutung und ermöglichen durch die Auswertung großer Datensätze neue Erkenntnisse, die über das Individuum hinausgehen. Die Endotoxinaktivitätsbestimmung ist dabei häufig nur ein Baustein, wenn Arbeitsbereiche hinsichtlich möglicher (Bioaerosol-)Belastungen beschrieben werden sollen. Probenahme und Extraktion müssen deshalb auf die weiteren Messungen (Glucane, Allergene u. a.) abgestimmt werden [24; 31].
Ein wichtiger Kontrollwert bei der Messung der Endotoxinaktivität ist die Wiederfindungsrate (Recovery) von definiert zugesetzten Endotoxinmengen. Zu diesem Zweck wird jede Probe doppelt angesetzt: einmal mit und einmal ohne Zusatz von 5 EU/ml Endotoxin. Damit wird überprüft, inwieweit die jeweilige Probe Einfluss auf den Nachweis der Endotoxinaktivität hat. Liegt die Recovery außerhalb von 50 bis 200 %, gilt der Messwert als nicht zuverlässig. Üblicherweise verliert der Störfaktor durch Verdünnung der Probe seinen Einfluss, sodass in der verdünnten Probe eine valide Messung der Endotoxinaktivität erfolgen kann. Die Bedeutung der Recovery-Werte zeigte sich auch für die hier dargestellten Proben: Die Endotoxinaktivität der Sammler, die mit Tween extrahiert wurden, zeigten, wenn sie fälschlicherweise auf eine Standardkurve ohne Tween bezogen wurde, fast durchweg Recoverywerte unter 50 oder über 200 %. Ebenso verhielt es sich, wenn Proben, die ohne Tween extrahiert wurden, fälschlicherweise auf eine Standardkurve mit Tween bezogen wurden. Das Extraktionsmedium ist also unbedingt auch in der Standardkurve zu berücksichtigen, die Recovery stellt dabei einen wichtigen Kontrollwert dar.
5 Fazit
Der LAL-Test ist als zuverlässige Methode zur Ermittlung der Endotoxinaktivität anzusehen; der analytische Fehler (Variationskoeffizient) liegt generell unter 20 % [31]. Die hohe Variabilität der Exposition ist, wie Spaan et al. [31] anhand eines über 2 000 Messungen umfassenden Datensatzes zeigen konnten, typisch für Endotoxin. Schließlich beruht die Endotoxinexposition – anders als zum Beispiel die gegenüber Chemikalien – auf sich exponentiell vermehrenden Gram-negativen Bakterien. Wichtig für die Beurteilung einer Endotoxinexposition ist jedoch, dass zu einer Angabe der Endotoxinaktivität auch immer die Nennung des verwendeten Tests und zusätzlich des Extraktionsverfahrens gehört, da diese nicht durch verbindliche Normvorgaben geregelt sind. Im Rahmen der Extraktion stellt die Verwendung von Detergens (Tween) die wichtigste Einflussgröße dar, da es direkt mit dem Testreagenz interagiert. Je nach Höhe der Endotoxinaktivität wirkt sich das unterschiedlich aus, wie unsere Daten belegen.
Vor allem im Hinblick auf epidemiologische Studien, die jenseits einzelner Arbeitsplatzmessungen die multiplen Belastungen ganzer Arbeitsbereiche erfassen sollen, müssen zuverlässige Messstrategien zum Einsatz kommen. Wichtig ist dabei auch, dass im Sinne einer kosteneffizienten Arbeit aus einer Staubsammlung gleichzeitig so verschiedene Parameter wie Endotoxine, Mikroorganismen, Allergene oder die pyrogene Aktivität bestimmt werden müssen. Kompromisse im Hinblick auf diese Mehrfachanalysen sind unerlässlich und unproblematisch, sofern die methodischen Einflussgrößen bekannt sind.
Literatur
- Liebers, V.; Raulf-Heimsoth, M.; Linsel, G.; Goldscheid, N.; Düser, M.; Stubel, H.; Brüning, T.: Evaluation of quantification methods of occupational endotoxin exposure. J. Toxicol. Environ. Health A 70 (2007), S. 1798-1805.
- Liebers, V.; Raulf-Heimsoth, M.; Brüning, T.: Health effects due to endotoxin inhalation. Arch. Toxicol. 82 (2008), S. 203-210.
- van Kampen, V.; Sander, I.; Liebers, V.; Deckert, A.; Neumann, H.-D.; Buxtrup, M.; Willer, E.; Felten, C.; Jäckel, U.; Klug, K.; Brüning, T.; Raulf, M.; Bünger, J.: Concentration of bioaerosols in composting plants using different quantification methods. Ann. Occup. Hyg. 58 (2014), S. 693-706.
- Endotoxins – Health-based recommended occupational exposure limit. Hrsg.: Health Council of the Netherlands, S. 15-19. Den Haag, Niederlande 2010. www.gezondheidsraad.nl/sites/default/files/201004OSH.pdf
- Castellan, R. M.; Olenchock, S. A.; Kinsley, K. B.; Hankinson, J. L.: Inhaled endotoxin and decreased spirometric values. An exposure-response relation for cotton dust. N. Engl. J. Med. 317 (1987), S. 605-610.
- DIN EN 13098: Arbeitsplatzatmosphäre – Leitlinien für die Messung von Mikroorganismen und Endotoxin in der Luft. Berlin: Beuth 2001.
- Spaan, S.; Heederik, D. J.; Thorne, P. S.; Wouters, I. M.: Optimization of airborne endotoxin exposure assessment: effects of filter type, transport conditions, extraction solutions, and storage of samples and extracts. Appl. Environ. Microbiol. 73 (2007), S. 6134-6143.
- Linsel, G.; Kolk, A.: Verfahren zur Bestimmung der Endotoxinkonzentration in der Luft am Arbeitsplatz (Kennzahl 9450). In: IFA-Arbeitsmappe Messung von Gefahrstoffen. 28. Lfg. IV/2002. Hrsg.: Deutsche Gesetzliche Unfallversicherung (DGUV), Berlin. Erich Schmidt, Berlin 1989 – Losebl.-Ausg. www.ifa-arbeitsmappedigital.de/9450
- Noss, I.; Doekes, G.; Sander, I.; Heederik, D. J.; Thorne, P. S.; Wouters, I. M.: Passive airborne dust sampling with the electrostatic dustfall collector: optimization of storage and extraction procedures for endotoxin and glucan measurement. Ann. Occup. Hyg. 54 (2010), S. 651-658.
- Liebers, V.; van Kampen, V.; Bünger, J.; Düser, M.; Stubel, H.; Brüning, T.; Raulf-Heimsoth, M.: Assessment of airborne exposure to endotoxin and pyrogenic active dust using electrostatic dustfall collectors (EDCs). J. Toxicol. Environ. Health A 75 (2012), S. 501-507.
- Zahradnik, E.; Sander, I.; Kendzia, B.; Fleischer, C.; Brüning, T.; Raulf-Heimsoth M.: Passive airborne dust sampling to assess mite antigen exposure in farming environments. J. Environ. Monit. 13 (2011), S. 2638-2644.
- Madsen, A.; Tendal, K.; Schlünssen, V.; Heltberg, I.: Organic dust toxic syndrome at a grass seed plant caused by exposure to high concentrations of bioaerosols. Ann. Occup. Hyg. 56 (2012), S. 776-788.
- Noss, I.; Wouters, I. M.; Visser, M.; Heederik, D. J.; Thorne, P. S.; Brunekreef, B.; Doekes, G.: Evaluation of a low-cost electrostatic dust fall collector for indoor air endotoxin exposure assessment. Appl. Environ. Microbiol. 74 (2008), S. 5621-5627.
- Thorne, P. S.; Reynolds, S. J.; Milton, D. K.; Bloebaum, P. D.; Zhang, X.; Whitten, P.; Burmeister, L. F.: Field evaluation of endotoxin air sampling assay methods. Am. Ind. Hyg. Assoc. J. 58 (1997), S. 792-799.
- Schierl, R.; Heise, A.; Egger, U.; Schneider, F.; Eichelser, R.; Neser, S.; Nowak, D.: Endotoxin concentration in modern animal houses in southern Bavaria. Ann. Agric. Environ. Med. 14 (2007), S. 129-136.
- Normand, A. C.; Ranque, S.; Cassagne, C.; Gaudart, J.; Sallah, K.; Charpin, D. A.; Piarroux, R.: Comparison of air impaction and electrostatic dust collector sampling methods to assess airborne fungal contamination in public buildings. Ann. Occup. Hyg. 60 (2016), S. 161-175.
- Raulf, M.; Buters, J.; Chapman, M.; Cecchi, L.; de Blay, F.; Doekes, G.; Eduard, W.; Heederik, D.; Jeebhay, M. F.; Kespohl, S.; Krop, E.; Moscato, G.; Pala, G.; Quirce, S.; Sander, I.; Schlünssen, V.; Sigsgaard, T.; Walusiak-Skorupa, J.; Wiszniewska, M.; Wouters, I. M.; Annesi-Maesano, I.: Monitoring of occupational and environmental aeroallergens – EAACI Position Paper. Concerted action of the EAACI IG Occupational Allergy and Aerobiology & Air Pollution. Allergy 69 (2014), S. 1280-1299.
- Sander, I.; Lotz, A.; Zahradnik, E.; Raulf, M.: Allergen quantification by use of Electrostatic Dust Collectors (EDCs): Influence of deployment time, extraction buffer, and storage conditions on the results. Ann. Occup. Hyg. 60 (2016), S. 845-859.
- Spaan, S.; Doekes, G.; Heederik, D.; Thorne, P. S.; Wouters, I. M.: Effect of extraction and assay media on analysis of airborne endotoxin. Appl. Environ. Microbiol. 74 (2008), S. 3804-3811.
- Douwes, J.; Versloot, P.; Hollander, A.; Heederik, D.; Doekes, G.: Influence of various dust sampling and extraction methods on the measurement of airborne endotoxin. Appl. Environ. Microbiol. 61 (1995), S. 1763-1769.
- Krop, E. J.; Jacobs, J. H.; Sander, I.; Raulf-Heimsoth, M.; Heederik, D. J.: Allergens and b-glucans in dutch homes and schools: characterizing airborne levels. PLoS One 8 (2014), e88871.
- Punsmann, S.; Liebers, V.; Lotz, A.; Brüning, T.; Raulf, M.: Ex vivo cytokine release and pattern recognition receptor expression of subjects exposed to dampness: pilot study to assess the outcome of mould exposure to the innate immune system. PLoS One 8 (2013), e82734.
- Normand, A. C.; Vacheyrou, M.; Sudre, B.; Heederik, D. J., Piarroux, R.: Assessment of dust sampling methods for the study of cultivable-microorganism exposure in stables. Appl. Environ. Microbiol. 75 (2009), S. 7617-7623.
- Walser, S. M.; Gerstner, D. G.; Brenner, B.; Bünger, J.; Eikmann, T.; Janssen, B.; Kolb, S.; Kolk, A.; Nowak, D.; Raulf, M.; Sagunski, H.; Sedlmaier, N.; Suchenwirth, R.; Wiesmüller, G.; Wollin, K. M.; Tesseraux, I.; Herr, C. E.: Evaluation of exposure-response relationships for health effects of microbial bioaerosols – A systematic review. Int. J. Hyg. Environ. Health 218 (2015), S. 577-589.
- Bang, F.: A bacterial disease of Limulus polyphemus. Bull. Johns Hopkins Hosp. 98 (1956), S. 325-351.
- Alwis, K. U.; Milton, D. K.: Recombinant factor C assay for measuring endotoxin in house dust: comparison with LAL, and (1 → 3)-beta-D-glucans. Am. J. Ind. Med. 49 (2006), S. 296-300.
- Thorne, P. S.; Perry, S. S.; Saito, R.; O‘Shaughnessy, P. T.; Mehaffy, J.; Metwali, N.; Keefe, T.; Donham, K. J.; Reynolds, S. J.: Evaluation of the Limulus amoebocyte lysate and recombinant factor C assays for assessment of airborne endotoxin. Appl. Environ. Microbiol. 76 (2010), S. 4988-4994.
- McKenzie, J. H.; Alwis, K. U.; Sordillo, J. E.; Kalluri, K. S.; Milton, D. K.: Evaluation of lot-to-lot repeatability and effect of assay media choice in the recombinant Factor C assay. J. Environ. Monit. 13 (2011), S. 1739-1745.
- Olenchock, S. A.; Lewis, D. M.; Mull, J. C.: Effects of different extraction protocols on endotoxin analyses of airborne grain dusts. Scand. J. Work Environ. Health 15 (1989), S. 430-435.
- Bogdanovic, J.; Wouters, I. M.; Sander, I.; Zahradnik, E.; Joanne, H. R.; Rodrigo, M. J.; Gómez-Ollés, S.; Heederik, D. J.; Doekes, G.: Airborne exposure to wheat allergens: optimised elution for airborne dust samples. J. Environ. Monit. 8 (2006), S. 1043-1048.
- Spaan, S.; Schinkel, J.; Wouters, I. M.; Preller, L.; Tielemans, E.; Nij, E. T.; Heederik, D.: Variability in endotoxin exposure levels and consequences for exposure assessment. Ann. Occup. Hyg. 52 (2008), S. 303-316.
Dr. rer. nat. Verena Liebers, Maria Düser, Dipl.-Stat. Benjamin Kendzia, Prof. Dr. med. Thomas Brüning, Prof. Dr. rer. nat. Monika Raulf, Institut für Prävention und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung, Institut der Ruhr-Universität Bochum (IPA), Bochum.